
| A.c(CH3COO-)= c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| B.c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,不一定是醋酸过量 |
| C.c(Na+)> c(CH3COO-)> c(OH-)> c(H+)时,一定是氢氧化钠过量 |
| D.c(CH3COO-)= c(Na+)时,该溶液一定呈中性 |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:不详 题型:填空题
 H++HA- HA-
H++HA- HA- H++A2-
H++A2-查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
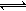 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )| A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①>②>③>④ | B.①>②>④>③ | C.①=②>③>④ | D.①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) 的大小关系是② ③(填“>”、“<”或“=”)
的大小关系是② ③(填“>”、“<”或“=”) 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原氨水物质的量浓度为0.1mol·L-1 |
| B.反应后的溶液中c(NH+4)+c(NH3·H2O)+c(NH3)=0.1mol·L-1 |
| C.反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
| D.原氨水中:c(NH+4)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH+4)相等的(NH4)2CO3溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2CO3]<c(NH4Cl) |
| B.Na2CO3溶液中:2c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3) |
| C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: c(Na+)>c(SO2-4)>c(OH-)=c(H+) |
| D.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com