
| A. | 在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等 | |
| B. | 化学反应的特征是有新物质生成 | |
| C. | 化学反应的过程实际上是一个旧键断裂,新键生成的过程 | |
| D. | 化学反应过程中一定有热量释放出来 |
分析 A.化学反应一定伴随能量变化,吸收或放出能量;
B.化学反应中一定有新物质生成;
C.断裂化学键吸收能量,形成化学键释放能量;
D.化学反应中可能释放热量,也可能吸收热量.
解答 解:A.化学反应一定伴随能量变化,吸收或放出能量,则化学反应中反应物的总能量与生成物的总能量一定不相等,故A正确;
B.化学反应中一定有新物质生成,即化学反应的特征是有新物质生成,故B正确;
C.断裂化学键吸收能量,形成化学键释放能量,化学反应中一定有旧键断裂,新键生成,故C正确;
D.化学反应中可能释放热量,也可能吸收热量,如C与二氧化碳反应为吸热反应,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、化学键与能量的关系、反应的实质为解答的关键,侧重分析与应用能力的考查,注意反应可能为吸热或放热反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②④ | C. | ①②⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+,Fe2+,Cl-,ClO- | B. | Na+,Cu2+,SO42-,NO3- | ||
| C. | Mg2+,NH4+,SO42-,Cl- | D. | Ba2+,CO32-,NO3-,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe是负极,NiO2是正极 | |
| B. | 蓄电池的电极可以浸入某中酸性电解质溶液中 | |
| C. | 充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放电时,电解质溶液中的阴离子向负极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-丙基辛烷 的名称为2,4-二乙基-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立体结构)有15种 | |
| D. | 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
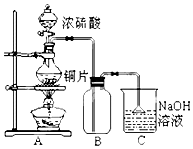 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: | ||
| C. | 过氧化钠的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com