
| A、前2 min D的平均反应速率为0.2 mol?L-1?min-1 |
| B、此时,B的平衡转化率是40% |
| C、增大该体系的压强,平衡不移动 |
| D、增加B,平衡向右移动,B的平衡转化率增大 |
| ||
| △t |
| ||
| 2min |
| 1 |
| 2 |
| 0.8mol |
| 2mol |


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
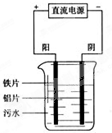 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
 次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Zn |
| B、Al、Cu |
| C、Al、Mg |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )| A、25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B、25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C、当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D、图中2a=b=6(c-b) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器Ⅰ、Ⅱ的右室中SO3的体积分数相同 |
| B、容器Ⅰ、Ⅱ的右室中反应速率I<II |
| C、平衡时容器Ⅰ、Ⅱ中的隔板均应在中间 |
| D、容器II若为绝热容器(隔板不导热),则容器II右室中SO2的转化率与左室SO3的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:4 | B、1:3 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50% | B、84% |
| C、42% | D、16% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )| A、T1<T2,p1>p2,m+n>p,Q<0 |
| B、T1>T2,p2>p1,m+n>p,Q<0 |
| C、T1>T2,p2>p1,m+n<p,Q<0 |
| D、T1>T2,p1<p2,m+n>p,Q>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com