
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
分析 硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度的KOH溶液时,生成的沉淀恰好完全溶解,发生总反应为:Al3++4OH-=AlO2-+2H2O,根据方程式可知,原溶液中c(Al3+)=$\frac{1}{4}$c(OH-),根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42),据此计算原溶液中K+离子的浓度,溶液中钾离子包括KOH含有的与原溶液中的钾离子,令溶液体积都是1L,根据n=cV计算混合后溶液中n(K+),进而计算混合后K+的浓度
解答 解:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度 KOH溶液时,生成的沉淀恰好完全溶解,发生总反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=$\frac{1}{4}$n(OH-),所以原溶液中c(Al3+)=$\frac{1}{4}$c(OH-)=$\frac{1}{4}$×0.2mol/L=0.05mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以原溶液中c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,
令混合溶液与氢氧化钾溶液的体积都是1L,则混合后溶液中n(K+)=1L×(0.25mol/L+0.2mol/L)=0.45mol,故反应后的溶液中K+的浓度为$\frac{0.45mol}{1L+1L}$=0.225mol/L,
故选:C.
点评 本题考查有关混合物的计算,题目难度不大,根据电荷守恒计算原混合溶液中钾离子浓度是关键.


科目:高中化学 来源: 题型:选择题
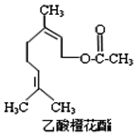 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) | A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 向某溶液中滴入2滴KSCN溶液,溶液不显血红色.再向溶液中滴入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl,2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>2ClO3->IO3- |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{32m}{n}$ | B. | $\frac{16m}{n}$ | C. | $\frac{32n}{m}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在Na2A溶液中有:c(OHˉ)=c(HAˉ)+c(H2A)+c(H+) | |
| C. | 在NaHA溶液中有:c(Na+)+c(H+)=c(HAˉ)+2 c(A2ˉ)+c(OHˉ) | |
| D. | 在Na2A溶液中有:c(Na+)>c(A2ˉ)>c(H+)>c(OHˉ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com