
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
分析 A.铜做电极,阳极失去电子的为金属铜;
B.铁遇浓硝酸发生钝化;
C.石墨中每个C原子与其它3个C形成碳碳键,根据均摊法计算出12g石墨中含有的碳碳键;
D.1个甲基含有9个电子;
解答 解:A.用铜作电极电解饱和NaCl溶液,阳极失去电子的是金属铜,不会生成气体,故A错误;
B.铁遇浓硝酸发生钝化所以转移电子数小于0.3NA,故B错误;
C.12g石墨中含有1molC,石墨中每个碳原子与其它3个C形成碳碳单键,每个C形成的碳碳键为:$\frac{1}{2}$×3=1.5,所以1molC形成了1.5mol碳碳键,12g石墨含有碳碳键数目为1.5NA,故C正确;
D.15g-CH3物质的量为1mol,含有的电子数为9NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,注意石墨、甲基的结构特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
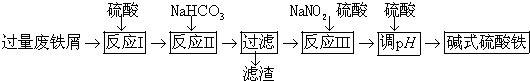
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
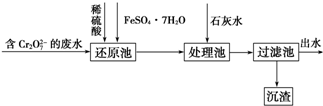
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
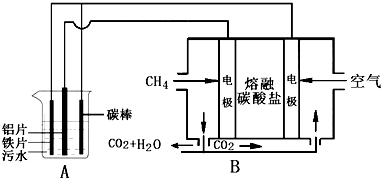
| A. | 装置B中通CH4一极电极反应为:CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 装置B中CO32-向CH4一极移动 | |
| C. | A中阳极相关反应有:Fe-2e-═Fe2+ 2H2O-4e-═4H++O2↑ 12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+ | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com