
【题目】下列电离方程式错误的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42﹣
B.H3PO4溶于水:H3PO4═3H++PO43﹣
C.HF溶于水:HF![]() H++F﹣
H++F﹣
D.NaHS溶于水:NaHS═Na++HS﹣,HS﹣![]() H++S2﹣
H++S2﹣
【答案】B
【解析】
A.盐(NH4)2SO4在溶液中完全电离,用等号表示,其电离方程式为(NH4)2SO4=2NH4++SO42﹣,正确;
B.H3PO4是弱酸,在溶液中部分电离,主要以电解质分子存在,存在电离平衡,用可逆号表示,多元弱酸要分步电离,其第一步的电离方程式为:H3PO4![]() H++H2PO4﹣,错误;
H++H2PO4﹣,错误;
C.HF属于弱酸,在溶液中部分电离,用可逆号表示,其电离方程式为:HF![]() H++F﹣,正确;
H++F﹣,正确;
D.NaHS是强电解质,在溶液中完全电离成Na+和HS﹣,HS﹣是弱酸的酸根离子,存在电离平衡,在溶液中部分电离,所以电离方程式为:NaHS=Na++HS﹣,HS﹣![]() H++S2﹣,正确。
H++S2﹣,正确。
故选B。


科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用200mL 3.00mol∕L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.15mol。(忽略溶液体积的变化)
(1)求原NaOH溶液的质量分数(保留两位小数);___________
(2)所得溶液Cl-中的物质的量浓度;__________
(3)所用氯气和参加反应的氢气的物质的量之比。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修5:有机化学基础】
苯并环己酮是合成萘(![]() )或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示:
)或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示:

己知:
回答下列问题:
(l)萘的分子式为_______;苯并环己酮所含官能团是_______(填名称)。
(2)Y的结构简式为_________。
(3)步骤Ⅲ的反应属于_________(填反应类型)。
(4)步骤Ⅳ反应的化学方程式为____________(标明反应条件)。
(5)苯并环己酮用强氧化剂氧化可生成邻苯二甲酸。邻苯二甲酸和乙二醇经缩聚反应生成的高分子化合物的结构简式是________。
(6)1-乙基萘的同分异构体中,属于萘的取代物的有_______种(不含1-乙基萘)。W也是1 -乙基萘的同分异构体,它是含一种官能团的苯的取代物,核磁共振氢谱显示W有三种不同化学环境的氢原子,且个数比为1:1:2,W的结构简式为_________。
(7)仍以苯并环己酮为原料,上述合成路线中,只要改变其中一个步骤的反应条件和试剂,便可合成萘。完成该步骤:__________(表示方法示例:A ![]() B)。
B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )
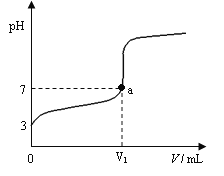
A. 该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B. 图中V1>20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C. 图中V1<20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) <c (Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为SiO2+3C![]() SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是SiO2,还原剂为C
B. 该反应中的氧化产物和还原产物的物质的量之比为1∶2
C. 该反应中转移的电子数为12e-
D. 该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com