
【题目】一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·c2(OH-)=Ksp。试推断氢氧化镁在下列溶液中的溶解度由大到小的顺序是
①0.1mol·L-1的AlCl3溶液②0.1mol·L-1的NH4Cl溶液
③0.1mol·L-1的KCl溶液④0.1mol·L-1的KAlO2溶液
A.①④③②
B.①②③④
C.③①④②
D.④①③②
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100ml溶液可能含有Na+、NH4+、Fe3+、 CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-) ≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19g某二价金属的氯化物ACl2中含有0.4molCl-离子,ACl2的摩尔质量是________,相对分子质量是__________,A的相对原子质量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
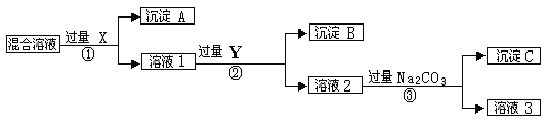
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X : ,沉淀A: ,试剂Y: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是 。
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不是健康文明的生活方式的是( )
A. 不偏食,注意营养均衡 B. 每天坚持适度锻炼
C. 沉迷网络聊天、游戏 D. 不吸烟、不酗酒,远离毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com