
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
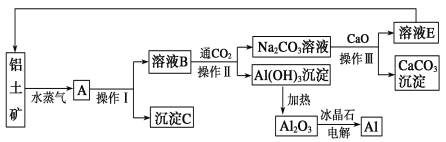
请回答下列问题:
(1)沉淀C的化学式为____,C与金属Al可以在高温下发生反应,可用于焊接铁轨。则该反应的化学方程式为_________。
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是____(填操作名称),实验室要洗涤Al(OH)3沉淀,洗涤方法是____________。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有______(填化学式)。用此法制取铝的副产品是______(填化学式)。
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:![]() ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
下列有关此工艺的说法合理的是______
A.冰品石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___(填化学式)。
【答案】Fe2O3 2Al+ Fe2O3=Al2O3 +2Fe 过滤 向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次 CaO和CO2 Fe2O3和O2 18 A SiO2
【解析】
根据流程图,氧化铝可以和氢氧化钠反应得到偏铝酸钠,氧化铁和氢氧化钠不反应,所以B是偏铝酸钠溶液,C是氧化铁,实现固体和液体的分离的方法是过滤,氢氧化铝受热分解得到氧化铝和水,电解氧化铝得到的是金属铝和氧气,据流程分析解题。
(1)因Al2O3+2NaOH═2NaAlO2+H2O,而Fe2O3不与NaOH溶液发生反应,因此过滤得到的沉淀C为Fe2O3,利用Fe2O3发生铝热反应制取Fe,即2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)操作Ⅰ、Ⅱ、Ⅲ均是除去不溶于液体的固体,即过滤,洗涤方法是向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次;
(3)据流程图可看出循环使用的物质除NaOH、H2O外,还有CaCO3![]() CaO+CO2↑,CaO与CO2也可循环使用;制取Al同时得到Fe2O3和O2;
CaO+CO2↑,CaO与CO2也可循环使用;制取Al同时得到Fe2O3和O2;
(4)2Al2O3(熔融)![]() 4Al+3O2↑,n(O2)=0.5mol,则m(Al)=
4Al+3O2↑,n(O2)=0.5mol,则m(Al)=![]() ×0.5mol×27g/mol=18g;
×0.5mol×27g/mol=18g;
A.Al2O3的熔点很高,熔化得需要较多能量,加入冰晶石可以降低熔化温度,故A正确;
B.由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层,故B错误;
C.电解过程中如果是金属做阳极,将参与电极反应,故C错误;
D.电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好,故D错误;
故答案为:A;
(5)铝土矿中含有二氧化硅,可以和氢氧化钠反应生成硅酸钠溶液,向其中通二氧化碳可以得到硅酸沉淀,硅酸受热分解得到二氧化硅,所以生产过程中得到的氧化铝将混有杂质二氧化硅。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
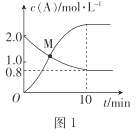
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
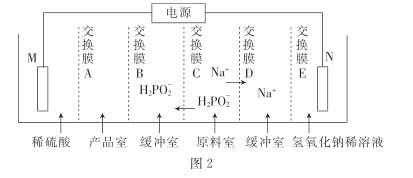
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
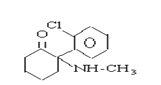
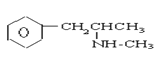
氯胺酮(K粉) 冰毒
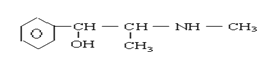
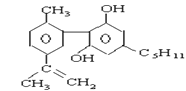
摇头丸 大麻
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2的浓溴水发生反应
D.摇头丸不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:_______;C、N、O的电负性由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们简单氢化物的沸点从高到低的顺序为______,其原因为______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价, [Cu(NH3)2]+中中心离子的电子排布式为______,其中碳原子的杂化轨道类型是______,NH3分子的VSEPR模型为______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
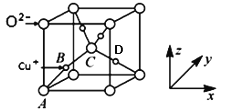
①若以A点为原点建立坐标系,A的坐标为(0,0,0),B的坐标为(![]() ),则D的坐标为______;
),则D的坐标为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为
①C3N3(OH)3![]() 3HNCO
3HNCO
②8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.反应①是氧化还原反应
B.反应②中HNCO是氧化剂
C.反应②中,每转移1 mol电子,消耗NO2 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
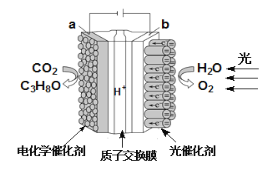
A.该装置工作时,H+从a极区向b极区迁移
B.该装置将化学能转化为光能和电能
C.a电极的反应式为3CO2+18H+-18e-=C3H8O+5H2O
D.每生成3 mol O2,有88 g CO2被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com