
分析 碱金属增重的为燃烧生成水和二氧化碳的总质量,二氧化碳、水与过氧化钠生成的气体为氧气,设出水和二氧化碳的物质的量,根据总质量、生成气体的物质的量列式计算,从而得出A分子中C、H原子数之比.
解答 解:①碱石灰增重的为二氧化碳和水的质量,设二氧化碳的物质的量为x,水的物质的量为y,则44x+18y=6.2;
二氧化碳、水都与过氧化钠反应生成氧气,标况下2.24L氧气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则二氧化碳和水的总物质的量为0.2mol,即:x+y=0.2,
联立解得:x=0.1mol、y=0.1mol,
所以A分子中C、H原子数之比为1:2,
故答案为:C、H原子数之比为1:2;
②若A是纯净物,则A可以是单烯烃,如:乙烯、丙烯等,若为烃的衍生物,可以为饱和一元醛、饱和一元羧酸,如甲醛、乙醛、甲酸、乙酸等,
故答案为:乙烯、甲醛、甲酸等;
③若A在常温常压下是两种气体的混合物,必须满足C、H原子数为1:2的气体,其可能的组合为:任意比组成的乙烯与丙烯,或按照1:1混合的甲烷与乙炔,或物质的量相等的乙烷与乙炔,
故答案为:乙烯与丙烯、甲烷与乙炔、乙烷与乙炔.
点评 本题考查有机物分子数的确定、混合物反应的计算,题目难度中等,注意掌握常见有机物结构与性质,注意掌握质量守恒定律在确定有机物分子式中的应用方法.


科目:高中化学 来源: 题型:多选题

| A. | d为石墨,铁片腐蚀加快 | |
| B. | d为石墨,石墨上电极反应为:Na++e-═Na | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为锌块,铁片上电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | O═O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
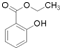 )广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下:
)广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下: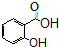 +C2H5OH?
+C2H5OH?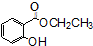 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数和核外电子数 | B. | 质量数和最外层电子数 | ||
| C. | 电子层数和最外层电子数 | D. | 电子层数和中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com