
分析 (1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;
(2)第一步完全电离,第二步部分电离,则Na2A溶液应呈碱性,NaHA溶液中主要存在HA-的电离,则溶液应呈酸性;
(3)0.1mol•L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析.
解答 解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐,A2-水解显碱性,水解离子反应为A2-+H2O?HA-+OH-,
故答案为:碱性;A2-+H2O?HA-+OH-;
(2)第一步完全电离,则NaHA溶液中主要存在HA-的电离,发生HA-?A2-+H+,溶液呈酸性,
故答案为:酸性;HA-?A2-+H+;
(3)0.1mol•L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L=0.11mol•L-1,
故答案为:<;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,则c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:B.
点评 本题考查盐类水解、离子浓度大小比较、弱电解质电离平衡等,明确习题中的信息是解答本题的关键,注意二元酸的两步电离特点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
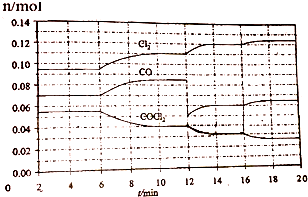
| A. | 1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率 | |
| B. | 若在6min时改变的条件为升高温度,则反应的平衡常数K增大 | |
| C. | 12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积 | |
| D. | 以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | BaCl2 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| C. | 在“催化剂对过氧化氢分解反应速率的影响”实验中,MnO2的用量以及颗粒直径的大小均会影响H2O2分解的速率,溶液的酸碱性对H2O2的稳定性也有较大的影响 | |
| D. | 在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 氯化钠溶液 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示为反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空.
已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示为反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com