
【题目】下列说法正确的是
A.NaHS在水中的电离方程式为NaHS=Na++HS﹣,HS﹣![]() H++S2﹣
H++S2﹣
B.氧化还原反应中,一种元素被氧化的同时必有另一种元素被还原
C.1mol配合物Fe(CO)5(羰基铁)中含有5mol配位键
D.氢氧化铁胶体带有正电荷,通电时向电源负极一端移动
【答案】A
【解析】
A.NaHS是盐,属于强电解质,在水中的电离方程式为NaHS=Na++HS-,HS-是H2S的酸式酸根离子,在水中发生电离作用,存在电离平衡,电离方程式为HS-![]() H++S2-,A正确;
H++S2-,A正确;
B.氧化还原反应中,氧化还原反应可能发生在同一元素的不同原子之间,因此不一定是一种元素被氧化的同时必有另一种元素被还原,B错误;
C.1mol配合物Fe(CO)5(羰基铁)中,不仅Fe、O之间有配位键,O-C原子之间也存在配位键,属于1mol配合物Fe(CO)5(羰基铁)中含有10mol配位键,C错误;
D.胶体不带电,氢氧化铁胶体的胶粒带有正电荷,通电时向电源负极一端移动,D错误;
故合理选项是A。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
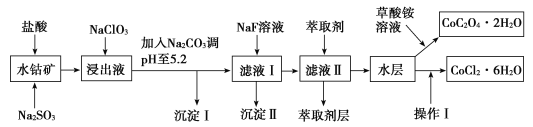
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示过程除去 AlCl3溶液中含有的 Mg2+、K+ 杂质离子并尽可能减小 AlCl3 的损失。下列说法正确的是
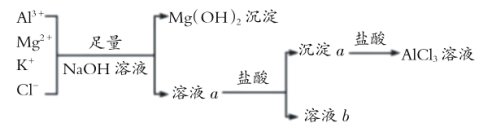
A.NaOH 溶液可以用Ba(OH)2溶液来代替B.溶液a中含有 Al3+、K+、Cl-、Na+、OH-
C.溶液 b 中只含有 NaClD.向溶液a和沉淀a中滴加盐酸都要过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
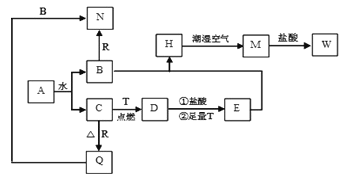
(1)写出下列物质的化学式:A:_____;E:______。
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:_______。
(3)按要求写方程式:B和R反应生成N的离子方程式:____________;M→W的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
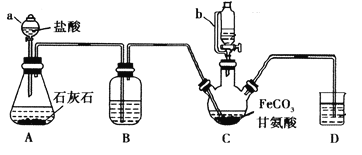
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g。计算此混合气体中:
(1)H2和CO的物质的量各为多少?_____________
(2)标准状况下,H2和CO的体积各为多少?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无色溶液X可能含有H+、Na+、NH4+、Mg2+、Al3+、CO32-、NO3-、SO42-中的几种离子,某化学兴趣小组通过如下实验确定了其成分(其中所加试剂均过量,气体体积已转化为标准状况):
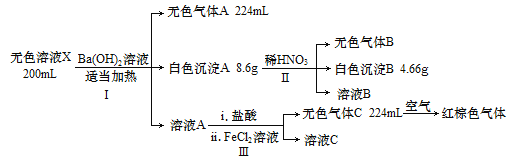
回答下列问题:
(1)实验Ⅱ可确定无色溶液X中一定不存在的离子有________。
(2)无色气体A的空间构型为_______;白色沉淀A的成分为_______(写化学式)。
(3)实验Ⅲ中的第ii步操作对应发生的反应的离子方程式为________。
(4)该无色溶液X中一定存在的阳离子及其物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机分子中,所有的原子不可能处于同一平面的是( )
A. CH2==CH2 B. CH2==CH—CH==CH2
C. CH2==C(CH3)—CH==CH2 D. CH2==CH—C≡CH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com