
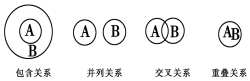
| A. | 化合物与电解质属于包含关系 | |
| B. | 氧化还原反应与化合反应属于包含关系 | |
| C. | 溶液与分散系属于并列关系 | |
| D. | 化合物与碱性氧化物属于交叉关系 |
分析 A.在水溶液中或溶质状态下能导电的化合物为电解质,化合物包含电解质;
B.部分氧化还原反应为化合反应,部分化合反应为氧化还原反应;
C.分散系分为溶液、胶体和浊液,溶液属于分散系的一种;
D.碱性氧化物属于氧化物,氧化物为化合物.
解答 解:A.在水溶液中或溶质状态下能导电的化合物为电解质,故电解质属于化合物,两者为包含关系,故A正确;
B.氧化还原反应和化合反应为交叉关系,不是包含关系,故B错误;
C.溶液、胶体和浊液都属于分散系,溶液包含在分散系中,属于包含关系,故C错误;
D.碱性氧化物属于氧化物的一种,而氧化物属于化合物,则化合物与碱性氧化物属于包含关系,故D错误;
故选A.
点评 本题考查了电解质与化合物、氧化还原反应、分散系等概念及判断,题目难度不大,明确电解质、氧化还原反应、分散系的概念即可解答,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=4.2×10-7 | |
| B. | 少量Cl2通入到过量的Na2CO3溶液的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2与Na2CO3按物质的量之比1:1恰好反应的离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到过量的NaClO溶液的离子方程式为2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的物质的量相等 | B. | O2比O3的质量小 | ||
| C. | 两种气体的分子数目相等 | D. | 两种气体中的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 移液时,不慎将液体流到瓶外 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 定容时俯视刻度线和液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲>乙>丙 | B. | 乙>甲>丙 | C. | 丙>甲>乙 | D. | 甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].
N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].查看答案和解析>>
科目:高中化学 来源: 题型:实验题
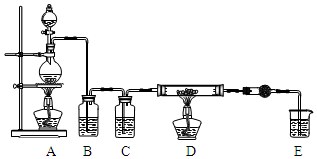 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com