
有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( )
A.X、W能形成共价化合物 B.Z、W能形成离子化合物
C.Y和Z不能形成化合物 D.Y分子中存在共价键
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:填空题
某非金属单质A经下图所示的过程转化为含氧酸D,
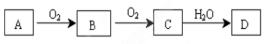
已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①氯水和B皆可作漂白剂。若同时使用于漂白一种物质时,其漂白效果是________(填“增强”“减弱”“不变” ),用化学方程式解释上述原因 ;
②D的浓溶液与铜发生反应的化学方程式: 。
(2)若A在常温下为气体,C是红棕色气体。
①A转化为B的化学方程式是:______________________________________,
② D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表 ( )
元素代号 | X | Y | Z | M | N | P |
原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:选择题
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.12C、13C、14C、金刚石、石墨都是碳元素的同位素
B.互为同位素的原子,质子数一定相同
C.同种元素的原子,质量数一定相同
D.由一种元素组成的物质,一定是纯净物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:填空题
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
__________________________________________________________________________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
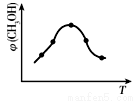
取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应热△H3_____0(填“>”、“<”或“=”),该反应的平衡常数表达式为______________________________________________________。

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。试回答:0~10 min内,氢气的平均反应速率为_________mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数_________(填“变大”、“减少”或“不变”)。
(3)脱硫。①有学者想利用如右图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则电子流出的电极为_____(用A或B表示),A极的电极反应式为______________________________。

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为_________________________;常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH_____7(填写“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2。下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2。下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省莆田市高一下学期期中化学试卷(解析版) 题型:选择题
检验SO2中是否有CO2,应采取的措施是( )
A.通过澄清石灰水
B.通过Ba(OH)2溶液再通过石灰水
C.通过酸性高锰酸钾溶液再通过石灰、
D.通过小苏打悬浊液再通过石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com