
下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )。
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Cu(NH3)4]Cl2
科目:高中化学 来源:2014年高二鲁科选修3化学训练2.2.2分子空间构型分子性质练习卷(解析版) 题型:选择题
判断下列分子为手性分子的是( )。
A.CH2Cl2
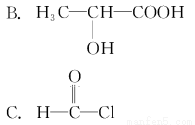
D.CH3CH2COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:填空题
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1 073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:选择题
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )。
A.NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.3离子键配位键与金属键练习卷(解析版) 题型:选择题
下列叙述错误的是( )。
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.两种不同的非金属元素可以组成离子化合物
C.配位键在形成时,是由成键双方各提供一个电子形成共用电子对
D.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:填空题
试回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-____________________;CS2____________________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
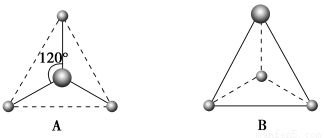
A:________________;B:________________。
(3)按要求写出第2周期非金属元素构成的中性分子的化学式:平面形分子________________,三角锥形分子________________,四面体形分子________________。
(4)下列一组微粒中键角由大到小顺序排列为________(用编号填写)
①HCN;②SiF4;③SCl2;④CO32-;⑤H3O+
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
sp3杂化形成的AB4型分子的空间构型是( )。
A.平面四边形 B.四面体形
C.四角锥形 D.平面三角形
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )。
A.Na+(g)+Cl-(g)=NaCl(s) ΔH
B.Na(s)+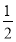 Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1
C.Na(s)=Na(g) ΔH2
D.Na(g)-e-=Na+(g) ΔH3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:选择题
下列有关电负性的说法中正确的是( )。
A.主族元素的电负性越大,元素原子的第一电离能一定越大
B.在元素周期表中,元素电负性从左到右越来越大
C.金属元素的电负性一定小于非金属元素的电负性
D.在形成化合物时,电负性越小的元素越容易显正价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com