
 |  |
| A.验证甲烷与氯气发生化学反应 | B.实验室制取乙酸乙酯 |
 |  |
| C.提取含杂质的粗苯甲酸 | D.提纯含杂质的工业酒精 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.光照下甲烷与氯气发生取代反应,生成的HCl可溶于水;
B.乙酸、乙醇发生酯化反应生成乙酸乙酯,饱和碳酸钠可除去乙醇、乙酸,降低乙酸乙酯的溶解度,试管中液体分层;
C.苯甲酸为无色、无味片状晶体,含杂质的粗苯甲酸因制备苯甲酸的方法不同所含的杂质不同,均可采用溶解→加入氢氧化钠→过滤→加适量稀盐酸→冰水混合溶液冷却→过滤→重结晶→提纯苯甲酸;
D.提纯含杂质的工业酒精,利用沸点差异,选择蒸馏法.
解答 解:A.光照下甲烷与氯气发生取代反应,生成的HCl可溶于水,则图中试管内液面上升,黄绿色气体减少或消失,故A正确;
B.乙酸、乙醇发生酯化反应生成乙酸乙酯,饱和碳酸钠可除去乙醇、乙酸,降低乙酸乙酯的溶解度,试管中液体分层,图中装置可制取乙酸乙酯,故B正确;
C.苯甲酸为无色、无味片状晶体,含杂质的粗苯甲酸因制备苯甲酸的方法不同所含的杂质不同,均可采用溶解→加入氢氧化钠→过滤→加适量稀盐酸→冰水混合溶液冷却→过滤→重结晶→提纯苯甲酸,不需要蒸发操作,故C错误;
D.提纯含杂质的工业酒精,利用沸点差异,选择蒸馏法,图中温度计的位置、冷水的方向等均合理,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质、混合物分离提纯、物质的制备等,把握实验装置、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
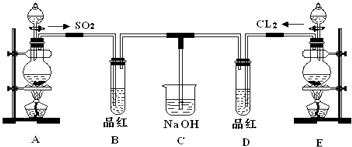
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
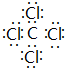 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与氧化铁高温下发生反应 | D. | 将锌粒投入FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑨ | B. | ①②⑤⑥⑧ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
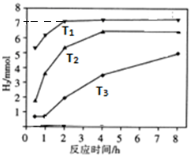 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.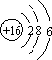 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com