
某无色溶液,可能由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成.取该溶液进行以下反应:
(1)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(2)在(1)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
(1)溶液中一定不存在的离子是________;
(2)一定存在的离子是________;
(3)判断沉淀乙成份的方法是________.
科目:高中化学 来源: 题型:阅读理解
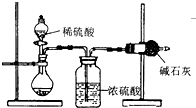 测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:| 106n |
| 197m |
| 106n |
| 197m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 水解 |
| 催化剂 |
| 发酵 |
| 催化剂 |
| 聚合 |
| 催化剂 |
| 催化剂 |
| 催化剂 |
| 发酵 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2014届河北省高三调研考试理综化学试卷(解析版) 题型:填空题
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。

①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由1~18号元素组成的化合物X是某抗酸药的有效成分。某同学欲探究X的组成。
查阅资料:①由1~18号元素组成的抗酸药的有效成分可能是碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
⑴Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是___________。
⑵由Ⅰ、Ⅱ判断X一定不含有的元素是磷、___________(填元素名称)。
⑶Ⅲ中生成B的离子方程式是___________。
⑷Ⅳ中B溶解的离子方程式是___________。
⑸沉淀C的化学式是___________。
⑹若上述n(A):n(B):n(C)=1:1:3,则X的化学式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com