
| A. | 维生素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |
科目:高中化学 来源: 题型:选择题
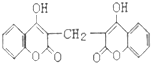 化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )
化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )| A. | 4 mol | B. | 5mol | C. | 6 mol | D. | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
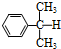 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: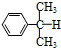 +O→
+O→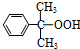 (异丙苯过氧氢)
(异丙苯过氧氢)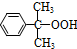 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$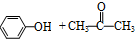 (丙嗣)
(丙嗣)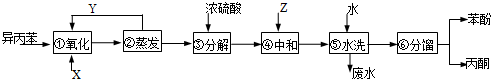
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
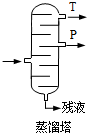 ,产品T是丙酮,
,产品T是丙酮, ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
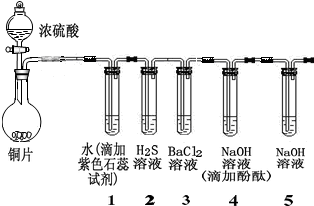
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
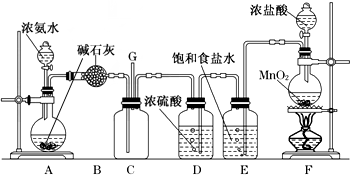
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com