
![]() ����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)
����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)![]()
![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____________________����֪��K300����K350������÷�Ӧ��______�ȷ�Ӧ��
��2����ͼ��ʾNO2�ı仯��������_______����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��_______________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
���𰸡���1�� ��
��2��b 1.5��10��3 mol��L��1��s��1 ��3��bc ��4��c
��������
�����������1�����淴Ӧ2NO��g��+O2��g��2NO2��g����ƽ�ⳣ��k=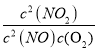 ��K��300�棩��K�� 350������˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
��K��300�棩��K�� 350������˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
��2���ɷ���ʽ2NO��g��+O2��g��2NO2��g����֪��ƽ��ʱ��c��NO������c��O2������c��NO2��=2��1��2���ɱ������ݿ�֪��ƽ��ʱ��c��NO��=![]() =0.00625mol/L������bƽ��ʱ��Ũ��Ϊ0.00625mol/L��������b��ʾNO2��Ũ�ȱ仯��
=0.00625mol/L������bƽ��ʱ��Ũ��Ϊ0.00625mol/L��������b��ʾNO2��Ũ�ȱ仯��![]() ��ͼ�����ݿ�֪2s�ڣ�NO��Ũ�ȱ仯��Ϊ0.01mol/L��0.004mol/L=0.006mol/L����v��NO��=
��ͼ�����ݿ�֪2s�ڣ�NO��Ũ�ȱ仯��Ϊ0.01mol/L��0.004mol/L=0.006mol/L����v��NO��=![]() =0.003mol/��Ls������������֮�ȵ��ڻ�ѧ������֮�ȣ���v��O2��=1/2v��NO��=1/2��0.003mol/��Ls��=1.5��10��3 mol��L��1��s��1 ���ʴ�Ϊ��b��0.0015mol/��Ls������3��a��δָ���������ʣ�����Ϊͬһ�������ʣ�ʼ�ն�����v��NO2��=2v��O2����ϵ���ʲ���˵������ƽ�⣬��Ϊ��ͬ��������ʣ�����֮�ȵ��ڻ�ѧ������֮�ȣ�˵������ƽ�⣬a����
=0.003mol/��Ls������������֮�ȵ��ڻ�ѧ������֮�ȣ���v��O2��=1/2v��NO��=1/2��0.003mol/��Ls��=1.5��10��3 mol��L��1��s��1 ���ʴ�Ϊ��b��0.0015mol/��Ls������3��a��δָ���������ʣ�����Ϊͬһ�������ʣ�ʼ�ն�����v��NO2��=2v��O2����ϵ���ʲ���˵������ƽ�⣬��Ϊ��ͬ��������ʣ�����֮�ȵ��ڻ�ѧ������֮�ȣ�˵������ƽ�⣬a����
b���淴Ӧ�������������ʵ�����С��ѹǿ����С��������ѹǿ���ֲ��䣬˵������ƽ�⣬b��ȷ��c����ͬ���ʱ�ʾ����������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��v����NO��=2v����O2����˵������ƽ�⣬c��ȷ��d����Ӧ���������������䣬����������������ܶ�ʼ�ղ��䣬�����������ʵ��ܶȱ��ֲ��䣬����˵������ƽ�⣬d����ѡbc��
��4��a����ʱ�����NO2���壬ƽ��������Ӧ�ƶ�������Ӧ���ʽ��ͣ�a����b���ʵ������¶ȣ���Ӧ��������ƽ�����淴Ӧ�ƶ���b����c������O2��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ���c��ȷ��d��ѡ���Ч�Ĵ���������Ӧ���ʣ���Ӱ��ƽ���ƶ���d����ѡc��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)��Ƶ�ԭ�����ͼ��ʾ����ش��������⣺

��1���缫X�IJ�����______ ���缫Y������__________ ��
��2�����缫�Ϸ����ĵ缫��ӦΪ____________��X�缫�Ϸ����ĵ缫��ӦΪ____________��
��3�����·�еĵ����Ǵ�______�缫����______�缫��������X������Y����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ϡ������п��ȡ������ʵ���У����ַ�Ӧ������ͬ����Ӧ���ʲ�ͬ����
�ش��������⣺
��1������ϡ������п��ȡ������ʵ���У�������������ͭ��Һ�ɼӿ��������������ʡ�
����������ͭ��Һ����Լӿ������������ʵ�ԭ���� ��
��ʵ����������Na2SO4��MgSO4��Ag2SO4��K2SO4��4����Һ����������ʵ����CuSO4 ��Һ���������õ��� ��
��Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬��ͬѧ���������һϵ�е�ʵ�飺�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���������У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
ʵ�� �����Һ | A | B | C | D | E | F |
4 mol/L H2SO4��mL�� | 30 | V1 | V2 | V3 | V4 | V5 |
����CuSO4��Һ��mL�� | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O��mL�� | V7 | V8 | V9 | V10 | 10 | 0 |
����ɴ�ʵ����ƣ����У�V1�� ��V6�� ��
��ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߣ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ�� ��
��2����ͬѧΪ̽���������ض�п��ϡ������Ӧ���ʵ�Ӱ�죬����������ʵ�飬��¼�������£��ش��������⣺
����ʵ�����֪����Ӧ��������� ����������������������������������
��ʵ��2��5������ �Է�Ӧ������Ӱ�졣
��ʵ��4��5������ �Է�Ӧ������Ӱ�죬 ��Ӧ����Խ�죬
�ܱ���ͬһ���ɵ�ʵ�黹�� ����ʵ����ţ���
����ʵ����Ӱ�췴Ӧ���ʵ��������ػ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�ص���±ˮ(��Cl����Br����Na����Mg2��)��װ����ͼ��ʾ(a��bΪʯī�缫)������˵���У���ȷ����

A����ع���ʱ��������ӦʽΪO2��2H2O��4e��===4OH��
B�����ʱ��a�缫��Χ���ȷŵ����Cl����������Br��
C�����ʱ����������·���ǣ������D�����·�D�������D����Һ�D�������D������
D������������ģ������������0.02 g H2ʱ��b����Χ�����0.02 g H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.05 mol Na2CO3��������ˮ���100mL��Һ������Һ�м����������ʡ��йؽ�����ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼΪʵ�����Ʊ����ռ�����HCl��װ�á�

�� �Ʊ�HCl����ҩƷΪŨ�����Ũ���ᣬ������װ��Ӧѡ����ͼ�е� ��

�� ���������Ũ�����Ũ�����Ʊ�HCl�����ԭ�� ��
�� װ�ñ��������չ�����HCl���壬Ϊ��ֹ���������ձ���Ӧ��װ��ˮ�� ��
��2������Ϊ����ȡ����Ӧ��̽��ʵ�顣

������ͼ��ʾ��װ��ͼ���Ӻø�������
������װ�õ������ԡ�
����A�м��������ı���Һ��Ļ��Һ�壬��B�м����������ۣ�������Ƥ������K1����ʼ���з�Ӧ�������������Һ�ر�K1��
д��B�з�����Ӧ�Ļ�ѧ����ʽ ��װ��C�������� ��
����Ӧ���������Թ�ȡ����D�е���Һ������
�������Լ���������֤��B�е�ȡ����Ӧ�Ѿ�������
����B�еĹ�Һ���������ˣ������Һ���������ͼ�������ƺ��б�������屽�������Լ�Ϊ ����������Ϊ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4������ӡ�N4���ӽṹ��ͼ��ʾ������˵����ȷ����( )

A��N4��������һ�����͵Ļ����� B��N4������ֻ���зǼ��Լ�
C��1molN4�����������ۼ���Ϊ4NA D��N4�е��P4(����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��仯���ﳣӦ�����л���ķ�Ӧ�ͷ���֮�У�ij�����廯����A����ʽΪC8H10O2 ,Ϊ�ⶨ��ṹ�����·�����
��1��Ϊȷ���ǻ��ĸ�������1mol A�������Ʒ�Ӧ��������22��4L(��״����)��˵��A�����к��ǻ�
����
��2���˴Ź���������ʾA��3���壬�����֮��Ϊ1��2��2�������ʵĽṹ��ʽΪ ��
��3��A��Cu���¿ɱ��������������л���B��B����Է���������AС4����д����Ӧ�ķ���ʽ ��
��4���л���F���л���B��һ��ͬ���칹�塣1mol F�������Ʒ�Ӧͬ����������22��4L(��״����)����F��ʹ�Ȼ�����Һ����ɫ����д��������������л���F�Ľṹ��ʽ ��ֻд��һ�ּ��ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص�����ת����Ҫ��ʽ�� ���ڵ����е�����������Ϊ ����a��b ��ʾ����
��2��������ӦʽΪ ��
��3���缫����Ʋ�����ԭ���� ��
��4���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ���������
�ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�w.w.w..c.o.m��2Li��H2![]() 2LiH ��LiH��H2O��LiOH��H2��
2LiH ��LiH��H2O��LiOH��H2��
�ٷ�Ӧ���е��������� ��
����֪LiH�����ܶ�Ϊ0.82g/cm3���������224L����״����H2�����ɵ�LiH����뱻���յ�H2�����Ϊ ��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80����������ͨ�����ӵ����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com