
| A. | 淀粉 | B. | 天然气 | C. | 聚乙烯 | D. | 葡萄糖 |
分析 相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物,淀粉、纤维素、蛋白质为天然高分子化合物.
解答 解:A.淀粉的相对分子质量在10000以上,天然存在,为天然有机高分子化合物,故A选;
B.天然气为混合物,主要成分为甲烷,甲烷相对分子质量为16,为小分子,故B不选;
C.聚乙烯可由乙烯发生加聚反应生成,为合成高分子,故C不选;
D.葡萄糖的分子式为C6H12O6,相对分子质量在10000以下,不是高分子,故D不选;
故选A.
点评 本题考查天然高分子化合物的判断,为基础性习题,把握有机物的组成、相对分子质量及获得方式为解答的关键,侧重分析与应用能力的考查,注意常见的天然高分子,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
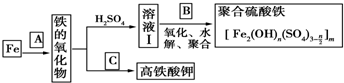
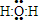 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | c( Al 3+)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,11.2LH2O所含的分子数为0.5NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02NA | |
| D. | 18g H2O和H2O2的混合物含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月波成露露成霜,借与南枝作淡妆 | B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | ||
| C. | 粉骨碎身浑不怕,要留清白在人间 | D. | 莫道雪融便无迹,雪融成水水成冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| C. | 用溶解、过滤的方法分离K2MnO4和MnO2固体的混合物 | |
| D. | 用分液的方法分离煤油和汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
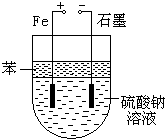 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com