
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
分析 A、混合物是由不同物质组成的;
B、酸性氧化物能和碱反应生成盐和水,一般溶于水生成碱;
C、在水溶液里或熔融状态下都不导电的化合物是非电解质;在水溶液中或熔融状态下导电的化合物是电解质;
D、在水溶液中或熔融状态下导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质;常见的电解质有酸、碱、盐、金属氧化物和水.
解答 解:A、海水是各种盐的水溶液、氯水是氯气的水溶液、氨水为氨气的水溶液,均为混合物,故A正确;
B、SiO2能与碱反应生成盐和水:SiO2+2NaOH=Na2SiO3+H2O,属于酸性氧化物,故B错误;
C、液氨是非电解质,液态氯化氢是电解质,故C错误;
D、干冰的水溶液能导电,原因是干冰和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,干冰是非电解质,冰和冰醋酸都是电解质,故D错误;
故选A.
点评 本题考查物质的分类,题目较为简单,掌握相关概念即可解答,学习中注意对概念的理解要准确.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
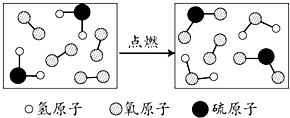
| A. | 反应物中有单质 | B. | 该反应为置换反应 | ||
| C. | 生成物的分子个数比为1:1 | D. | 化学反应前后原子的种类不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X两元素对应的单质发生反应只能得到W2X | |
| B. | 由X、Y、Z三种元素组成的物质其水溶液一定呈中性 | |
| C. | 1 mol Z2X2与足量水反应可得气体11.2 L | |
| D. | 四种元素在自然界中均以化合态存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com