
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O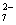 转
转
化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究
有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积mL | 草酸溶液体积mL |
|
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
测得实验①和②溶液中的Cr2O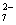 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明  ;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O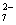 的浓度可用仪器测定。)
的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
科目:高中化学 来源: 题型:
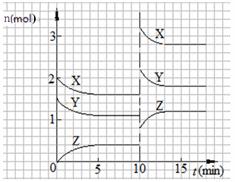
已知反应X(g)+Y(g)  nZ(g) △H<0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如右图。下列说法正确的是( )
nZ(g) △H<0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如右图。下列说法正确的是( )
A.反应方程式中n=2
B.该反应的△S>0
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,平均反应速率v(X)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
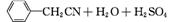

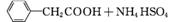
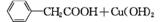
 (
(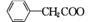 )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温到130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现代建筑的门窗框架常用电解加工成的古铜色硬铝制造,取硬铝样品进行如下实验(每一步中的试剂均过量):
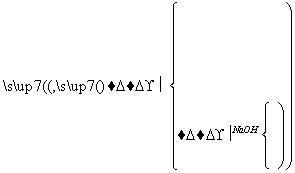
由此可推知,硬铝的组成为( )
A.Al、Cu、Mg、Si、Mn B.Al、Mg、Si、Zn
C.Al、Fe、C、Si D.Al、Si、Zn、Na
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3-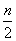 ]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________。
(2)固体产物成分的探究
 实验设计
实验设计
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
 思考与判断
思考与判断
根据上面的信息,可以确定固体产物的成分是________;步骤1中发生反应的离子方程式为
______________________________________________________________。
(3)气体产物成分的探究(不考虑水蒸气)
 提出假设
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是________。
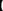 设计实验方案,验证假设
设计实验方案,验证假设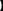
按下表的实验步骤写出预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若____________,则________成立 ②若____________,则________成立 |
| 步骤2:将气体产物缓缓通过浸在冰水中的U形
| 结合上述步骤1的有关结论__________(填①或②) ①若____________,则____成立 ②若____________,则____成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用 NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA
B.4.2 g丙烯中所含的共价键数目为0.6NA
C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA
D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为 ;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为 ;
(3)写出步骤③发生反应的离子方程式 ;
(4)步骤⑥的实验操作为 、过滤、烘干。
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的
SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于浓硫酸的叙述不正确的是( )
|
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 |
|
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
|
| C. | 浓硫酸是一种干燥剂,能够干燥二氧化硫、氢气等气体 |
|
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,
其中正确的是


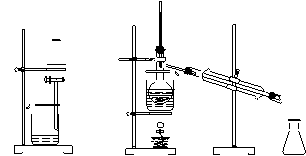

A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com