
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=$\frac{m}{M}$计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)根据电子流向可知a为负极,负极发生氧化反应,b为正极发生还原反应,溶液中阳离子移向正极;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;根据热化学方程式计算当可逆反应中净生成N-H物质的量为2mol 时,反应放出的热量;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$计算反应热.
解答 解:(1)4g氢气即2mol在O2中完全燃烧生成液态水,放出572kJ的热量,则1mol氢气在氧气中燃烧生成液态水,放出286kJ的热量,则表示H2的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a电极为负极,甲醇在负极上发生氧化反应,电极反应式为2CH3OH+2H2O-12e-═2CO2+12H+,b为正极,氧气得电子发生还原反应,电极反应式为3O2+12e-+12H+═6H2O,氢离子移向正极右侧,
故答案为:a;右;2CH3OH+2H2O-12e-═2CO2+12H+;3O2+12e-+12H+═6H2O;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,当可逆反应中净生成N-H物质的量为2mol 时,即生成$\frac{2}{3}$molNH3,所以反应放热为$\frac{2}{3}$×$\frac{1}{2}$×93=31KJ,故答案为:391;31KJ;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+$\frac{1}{2}$×(-571.6kJ/mol)-$\frac{1}{2}$×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、据键能计算焓变、盖斯定律的应用,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料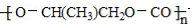 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内气体的密度不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为2:1 | |
| D. | 混合气体的质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=v(C)=0.75 mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C的体积分数为28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | N2 | NO | NO2 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-CH2CH2OH | B. |  | C. |  | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能电离出H+、Cl- | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | HF的沸点高于HCl | F的非金属性比Cl强 |
| D | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com