
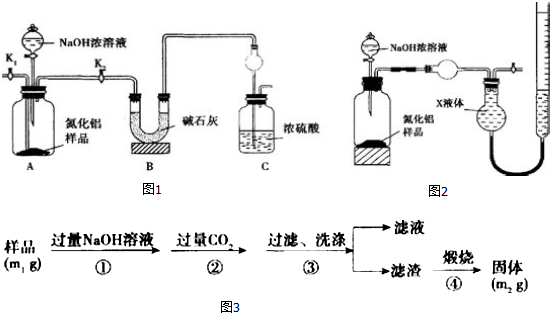
分析 (1)氨气是和浓硫酸能发生反应的气体,易发生倒吸,C装置中球形干燥管可以防止倒吸;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)图1 装置中空气中的水蒸气和二氧化碳也可以进入装置C,据此分析;
(4)氨气极易溶于水,量气装置中的X液体不能与氨气反应,不能使氨气溶解;
(5)依据AlN+NaOH+H2O═NaAlO2+NH3↑中的定量关系计算出样品中纯氮化铝的质量,再计算出氮化铝的质量分数;
(6)步骤①反应为AlN、Al2O3分别与氢氧化钠反应生成偏铝酸钠,氨气和水,根据电荷守恒书写离子方程式;
(7)依据杂质氧化铝在反应前后质量不变,而根据流程中铝的转化关系可得关系式2A1N~~A12O3,根据关系式进行列比例式,可计算出样品中氮化铝的纯度.
解答 解:(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,故答案为:防止倒吸;
(2)组装好实验装置,先检查装置气密性,加入实验药品,接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体,打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:把装置中残留的氨气全部赶入C装置;
(3)图1 装置中空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,故答案为:偏高;
(4)a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气与浓硫酸反应,故d错误;
故选a;
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AlN+NaOH+H2O═NaAIO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×10{\;}^{-3}}{22.4}$g,则AlN的质量分数=$\frac{41V×10{\;}^{-3}}{22.4m}$×100%=$\frac{41V}{22400m}$×100%,
故答案为:$\frac{41V}{22400m}$×100%;
(6)步骤①反应为AlN、Al2O3分别与氢氧化钠反应生成偏铝酸钠、氨气和水,反应的离子方程式为AlN+OH-+H2O=AlO2-+NH3↑、Al2O3+2OH-=2AlO2-+H2O,
故答案为:AlN+OH-+H2O=AlO2-+NH3↑、Al2O3+2OH-=2AlO2-+H2O;
(7)设样品中含有氧化铝杂质为x,依据铝守恒,得2A1N~~A12O3
82 102
m1-x m2-x
所以$\frac{82}{m{\;}_{1}-x}$=$\frac{102}{m{\;}_{2}-x}$,解之得:x=5.1m1-4.1m2,则质量分数为:$\frac{m{\;}_{1}-(5.1m{\;}_{1}-4.1m{\;}_{2})}{m{\;}_{1}}$×100%=$\frac{4.1{m}_{2}-4.1{m}_{1}}{{m}_{1}}$×100%,
故答案为:$\frac{4.1{m}_{2}-4.1{m}_{1}}{{m}_{1}}$×100%.
点评 本题考查了物质性质的探究实验设计和实验分析判断,实验基本操作和物质性质的掌握是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 防治环境污染,改善生态环境已成为全球共识.
防治环境污染,改善生态环境已成为全球共识.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氮化铝晶胞结构与NaCl相同 | B. | 第一电离能N<Al | ||
| C. | 电负性N>Al | D. | 原子半径N>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.3×1023 | B. | 3.3×1024 | C. | 7.5×1023 | D. | 7.5×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L?1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加入纯水中,水的电离程度不变 | |
| C. | 常温下,电离常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO?)大于同浓度CH3COONa溶液中的c(CH3COO?) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a的溶解度大于b的溶解度 | |
| B. | 在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 | |
| C. | 升高温度时,a、b溶解度均增大 | |
| D. | 在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com