
| A. | 铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| D. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应 |
分析 A.负极和阳极均失电子发生氧化反应;
B.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
C.升高温度,平衡向吸热方向移动;
D.盐的水解为吸热反应.
解答 解:A.铅蓄电池放电时的负极和充电时的阳极均发生失电子的氧化反应,故A错误;
B.Cu、Fe和电解质溶液构成原电池,Fe易失电子作负极、Cu作正极,所以Fe加速被腐蚀,故B正确;
C.N2(g)+3H2(g)?2NH3(g)△H<0,反应为放热反应,升高温度平衡应向吸热方向移动,即向逆向移动,氢气的转化率降低,故C错误;
D.盐的水解为吸热反应,加热促进碳酸钠的水解,有利于去污,说明纯碱的水解是吸热反应,故D错误;
故选:B.
点评 本题考查较为综合,涉及原电池、电解质工作原理,金属的腐蚀与防护,盐类的水解以及影响反应速率的因素,化学平衡移动的影响因素等问题,侧重考查学生综合运用化学知识的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
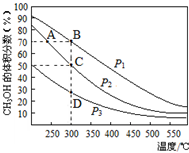 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 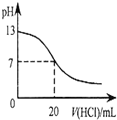 表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 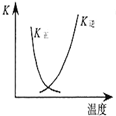 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 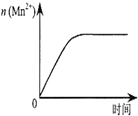 表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. |  图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卢瑟福提出了带核的原子结构模型 | |
| B. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,受PM2.5污染的大气不一定能产生丁达尔现象 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有的非金属元素 | |
| D. | 并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com