
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
 ,
,分析 由元素在周期表的位置可知,①~⑩分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br,
(1)Si为半导体材料,二氧化硅为光纤的材料;
(2)表中最活泼的金属为K,质子数为19;
(3)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
(4)二氧化硫与溴、水反应生成硫酸和HBr;
(5)利用金属与酸反应比较金属性.
解答 解:由元素在周期表的位置可知,①~⑩分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br,
(1)⑤的单质和氧化物的一种用途为Si作半导体材料,二氧化硅作光纤的材料,故答案为:Si作半导体材料,二氧化硅作光纤的材料;
(2)表中最活泼的金属为K,质子数为19,其离子的结构示意图是 ,故答案为:
,故答案为: ;
;
(3)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则②③⑦三种元素的离子半径大小为Cl->F->Mg2+,
故答案为:Cl->F->Mg2+;
(4)二氧化硫与溴、水反应生成硫酸和HBr,离子反应为SO2+Cl2+2H2O=4H++2Cl-+SO42-,故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(5)利用金属与酸反应比较金属性,实验为取相同大小的Mg、Al,分别与等浓度的盐酸反应,产生气泡快的为Mg,故答案为:取相同大小的Mg、Al,分别与等浓度的盐酸反应.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


科目:高中化学 来源: 题型:解答题

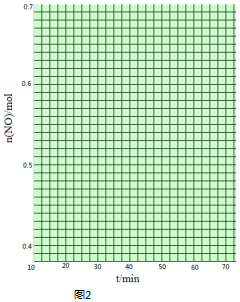
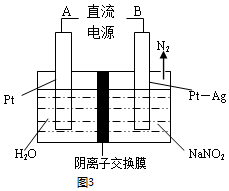
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
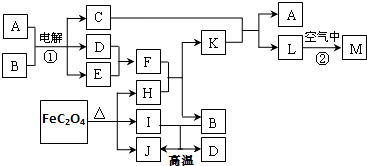
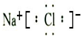 ,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.
,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.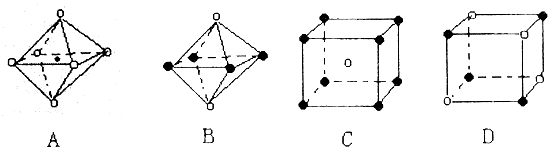
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
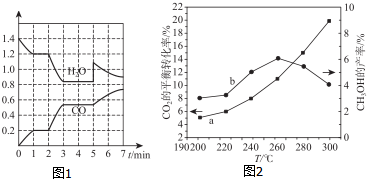
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
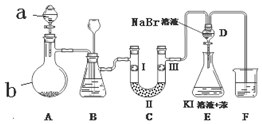
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
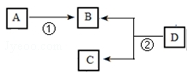 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com