
X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
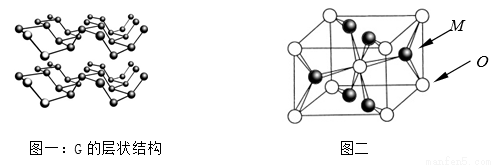
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2016-2017学年北京市怀柔区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A.浓硫酸的体积增大 B.铝的表面生成致密的薄膜
C.澄清的石灰水变浑浊 D.氢氧化钠的表面发生潮解
查看答案和解析>>
科目:高中化学 来源:北京市怀柔区2016-2017学年度第一学期期末考试高二化学试卷 题型:选择题
下列物质属于天然纤维且其主要成分是纤维素的是
A. 棉花 B. 光导纤维 C. 羊毛 D. 蚕丝
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
下列有关SO2和CO2的说法正确的是
A.都是非极性分子
B.中心原子都采取sp杂化
C.S原子和C原子都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期元素,X的一种原子没有中子,Y、Z易形成质量比为3︰4和3︰8的两种常见化合物,W所在的周期数和族序数相同。下列说法正确的是( )
A. W的最高价氧化物对应水化物是强碱 B. 原子最外层电子数:W>Z>Y
C. 原子半径:Y<Z<W D. X、Y可以形成既有极性键也有非极性键的化合物
查看答案和解析>>
科目:高中化学 来源:2017届湖北省、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
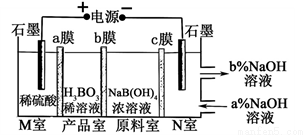
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:填空题
硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
甲醇属于可再生能源,可代替汽油作为汽车燃料,下列热化学方程式中的反应热能够正确表示甲醇燃烧热的是( )
A. CH3OH(l) + 3/2O2(g) =CO2(g) + 2H2O(l); △H =+726.5KJ/mol
B. CH3OH(l) + 3/2O2(g) =CO2(g) + 2H2O(l); △H = -726.5KJ/mol
C. CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(g); △H = -675.3KJ/mol
D. 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l); △H = -1453KJ/mol
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成A2D和A2D2,A2D是最常见的溶剂;E原子次外层电子电子数等于其它层电子数之和。则
(1)E在周期表中的位置是______________,B、C、D、E与A形成的化合物中稳定性最强的是_______(该化学式)。
(2)C、D、E的离子半径由大至小顺序______________。
(3)写出B与由A、C、D组成的化合物的浓溶液在加热条件下的反应方程式:_________。
(4)A-E五种元素中,含同一元素的各类物质能实现下列转化的有______(填元素符号)。
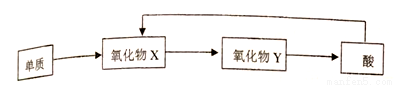
(5)A2D2与FeSO4溶于稀硫酸,反应的离子方程式为_________。
(6)由A、B、C、D四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为(名称)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com