
【题目】对如图所示的两种化合物的结构或性质描述正确的是:
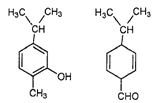
A. 均能与溴水反应B. 分子中肯定共平面的碳原子数相同
C. 不是同分异构体D. 可以用红外光谱区分,亦能用核磁共振氢谱区分
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |
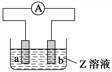
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。
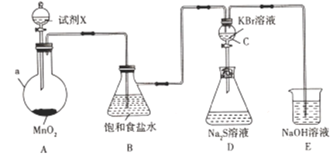
(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是
A. 苯与溴水反应:2![]() +Br2
+Br2![]()
B. 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH= CH3CH=CH2↑+NaCl+H2O
C. 苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2→C6H5OH+HCO3-
D. 实验室制取乙炔的反应:CaC2+H2O → CaO + CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便制取干燥NH3,下列方法中适合的是( )
A.NH4Cl与H2SO4(浓)混合加热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱干燥
2NH3,用烧碱干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4Cl用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在短周期元素中:
①元素周期表IA族中金属性最强的元素(符号)是____,与水反应最剧烈的VIIA族中的非金属元素的(符号)是___;
②原子核外电子总数是其最外层电子数2倍的元素名称是__,最外层电子数为电子层2倍的元素名称有____。
(2)已知某主族元素的原子结构示意图如图,Y在周期表的位置为___。

(3)A2-原子核内有x个中子,其质量数为m,则ngA2-所含电子的物质的量为__。
(4)X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。
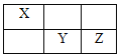
已知X、Y、Z三元素的原子序数之和为40,回答下列问题:
①Z元素的原子结构示意图为___。
②与Y同主族的下一周期元素的原子序数是___。
③X的气态氢化物与Y的最高价氧化物对应水化物发生的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )

A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com