
分析 根据锌的质量可求参加反应的硫酸铜的质量和生成的铜的质量;根据“反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量”,得出原硫酸铜溶液的质量;反应后溶液中剩余的硫酸铜的质量=原硫酸铜的质量-参加反应的硫酸铜的质量,据此分析.
解答 解:设参加反应的硫酸铜的质量为x,生成的铜的质量为y
Zn+CuSO4=Cu+ZnSO4
65 160 64
13g x y
$\frac{65}{13g}=\frac{160}{x}=\frac{64}{y}$,解之得x=32g,y=12.8g
反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量,即:
242.2g=13g+原硫酸铜溶液的质量-12.8g,得:
原硫酸铜溶液的质量=242.2g-13g+12.8g=242g;
剩余的硫酸铜的质量=原硫酸铜的质量-参加反应的硫酸铜的质量=242g×20%-32g=16.4g
答:则反应后溶液中剩余的硫酸铜的质量是16.4g.
点评 根据“反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量”,求出原硫酸铜溶液的质量是关键.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$ (1-a) | D. | $\frac{12}{13}$ (1-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
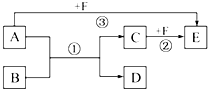 已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com