
用下面两种方祛可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)制取所需的FeSO4溶液需要的反应物为_______。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________。
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
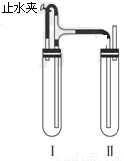
(3)在试管Ⅰ里加入的试剂是________________________________________。
(4)在试管Ⅱ里加入的试剂是________________________________________。
操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为:_____________。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________。
科目:高中化学 来源:2016-2017学年江苏省淮安市高一上学期期末调研测试化学试卷(解析版) 题型:选择题
下列除杂(括号内是杂质)所选用的试剂及操作方法均正确的一组是
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | CO2(HCl) | 饱和NaHCO3溶液 | 洗气 |
B | Mg(Al) | 过量稀盐酸 | 过滤 |
C | FeCl2溶液(FeCl3) | 足量Fe粉 | 过滤 |
D | CO2(CO) | O2 | 点燃 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一上学期期末考试(B卷)化学试卷(解析版) 题型:选择题
下列溶液中能用来区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③酸性KMnO4 ④氯水 ⑤品红溶液 ⑥紫色石蕊试液
A. ①②③⑤ B. ①⑥ C. ① D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:填空题
(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g) N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:

①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____极增重_______g。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期原子序数依将增大的5种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物的难排于水。下列说法不正确的是 ( )
A. 简单离子的半径:C>D>E>B
B. 工业上常用电解法制得C和D的单质
C. 稳定性: A2B>A2E
D. 单质D可用于冶炼某些难熔金属
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A. 锌与镁 B. 铁与锌 C. 铝与铁 D. 镁与铁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
在下列溶液中,能大量共存的离子组是( )
A. 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42-
B. 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl-
C. 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl-
D. 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高二上学期期末考试化学(文)试卷 题型:选择题
下图是产生和收集气体的实验装置示意图,该装置适合于
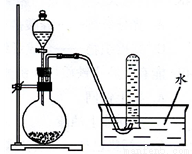
A. 用浓硝酸和Cu制取NO2
B. 用浓盐酸和MnO2制取Cl2
C. 用H2O2溶液和MnO2制取O2
D. 用NH4C1溶液和Ca(OH)2制取NH3
查看答案和解析>>
科目:高中化学 来源:2017届浙江省温州市高三第二次选考模拟考试(2月)化学试卷(解析版) 题型:填空题
【加试题】氮及其化合物在生活和生产中应用广泛。
(1)N2O是一种强大的温室气体,在一定条件下,其分解的化学方程式为:2N2O(g)=2N2(g)+O2(g) ΔH<0,你认为该反应的逆反应是否自发进行,请判断并说明理由___________。
某研究小组为针对N2O的分解进行研究,常温下,在1L恒容容器中充入0.100mol N2O气体,加热到一定温度后使之反应,请画出容器中气体的总浓度c(总)随时间t变化的总趋势图。_____________
(2)①N2O5是一种新型硝化剂。工业上可用N2O4通过电解制备N2O5,阴、阳极室之间用质子交换膜隔开,两极电解液分别为稀硝酸溶液和溶有N2O4的无水硝酸,用惰性电极电解时,生成N2O5极室的电极反应式为_____________。
②已知,一定条件下有下列反应:
Ⅰ2N2O5(g)  4NO2 (g)+ O2(g) ΔH1
4NO2 (g)+ O2(g) ΔH1
Ⅱ2NO2(g)  2NO (g)+ O2(g) ΔH2
2NO (g)+ O2(g) ΔH2
Ⅲ2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) ΔH3
写出NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式___________。
在容积为2L的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应Ⅰ、Ⅱ,若达到平衡状态后O2为1.00mol,NO2为0.400mol,则T℃时反应Ⅰ的平衡常数的值为_________。
(3)NH3和Cr2O3固体在高温下可以制备多功能材料CrN晶体,其反应为Cr2O3(s)+2NH3(g)  2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com