
| A、1105 kJ |
| B、1812.5 kJ |
| C、2520 kJ |
| D、3935 kJ |
| 28x+44y |
| x+y |
| 3 |
| 4 |
| 1 |
| 4 |
| 28x+44y |
| x+y |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 221 |
| 2 |
| 1 |
| 4 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、3.01×1020个 |
| B、6.02×1021个 |
| C、7.74×1020个 |
| D、6.67×1020个 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,则E的分子式为
,则E的分子式为 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
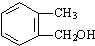 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2、Cl2、HCl、酸雨 |
| B、HCl、SO2、N2、粉尘 |
| C、NH3、CO、CO2、雾 |
| D、SO2、NO2、CO、烟尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 10 | 20 | 30 | 40 | 50 |
| N(SO3)/mol | 0.4 | 0.6 | 1.2 | 1.6 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com