
| A. | 18gH20中含有的中子数为10NA | |
| B. | 6.4g铜完全溶解于一定浓度的硝酸时,转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的Na2CO3溶液中,离子总数为0.3NA | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ•mol-1,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
分析 A.水分子中含有8个中子,18个水的物质的量为1mol,含有8mol中子;
B.根据n=$\frac{m}{M}$计算出铜的物质的量,再根据电子守恒计算出转移的电子数;
C.碳酸根离子部分水解,导致溶液中离子数目增多;
D.该反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,1mol水分子中含有8mol中子,含有的中子数为8NA,故A错误;
B.6.4g铜的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,0.1mol题完全反应转移了0.2mol电子,转移的电子数为0.2NA,故B正确;
C.1L0.1mol/L的Na2CO3溶液中含有0.1mol碳酸钠溶液,由于碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致溶液中离子数目增多,故C错误;
D.NA个HI分子的物质的量为1mol,由于该反应为可逆反应,则达到平衡时负极的HI的物质的量小于1mol,所以吸收的热量小于7.45kJ,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的计算与判断、可逆反应特点,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数、物质的量浓度等之间的关系为解答关键,注意掌握可逆反应特点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+ 1s22s22p6 | B. | N3+ 1s22s22p6 | C. | F?1s22s22p6 | D. | O2?1s22s22p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将亚硫酸钡加入到盐酸中:SO${\;}_{3}^{2-}$+2H+=SO2↑+H2O | |
| B. | 金属钾与水反应:K+H2O=K++OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铜屑:Cu+4H++NO-3=Cu2++2H2O+NO↑ | |
| D. | 向偏铝酸钠溶液中通过量CO2:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
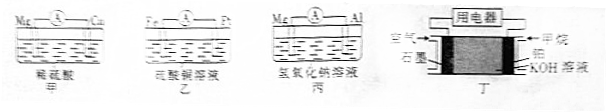
| 装置序号 | 负极 | 阳离子移向 (填电极材料名称) |
| 甲 | ||
| 乙 | . |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
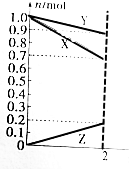 某温度时,在2L的容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为Y+3X=2Z.反应开始至2min,用Z表示的平均反应速率为0.05mol/(L.min).
某温度时,在2L的容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为Y+3X=2Z.反应开始至2min,用Z表示的平均反应速率为0.05mol/(L.min).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液可盛放在碱式滴定管中 | |
| B. | 可用酚酞或甲基橙作滴定的指示剂 | |
| C. | 若滴定管未用待测KMnO4溶液润洗,则会使测得的KMnO4溶液浓度偏小 | |
| D. | 滴定过程中褪色速率先慢后快,是由于锥形瓶中KMnO4溶液浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
足量块状铁与100 mL 0.01 mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )。
①加H2O②加NaOH固体③加CH3COONa固体
④加Na2CO3固体⑤加入NaNO3固体⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液⑧升高温度⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸
A.⑧⑨⑩ B.⑦⑧⑨ C.③⑦⑩ D.⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列名词中,哪个名词不属于物理量
A.长度 B.气体摩尔体积 C.摩尔 D.摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com