
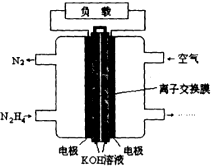
 �£�N2H4���ǻ�����䳣�õ�ȼ�ϣ�һ�����£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ�� ��ȼ�ϵ�صĵ缫���ϲ��ö������ϣ�����ߵ缫��Ӧ���ڵ缫���������������ʹ������������Һ��ֽӴ����Կ����е�������Ϊ��������KOH��Һ��Ϊ����ʣ�
�£�N2H4���ǻ�����䳣�õ�ȼ�ϣ�һ�����£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ�� ��ȼ�ϵ�صĵ缫���ϲ��ö������ϣ�����ߵ缫��Ӧ���ڵ缫���������������ʹ������������Һ��ֽӴ����Կ����е�������Ϊ��������KOH��Һ��Ϊ����ʣ�

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��W1=W2��W4��W3 |
| B��W2��W1��W3��W4 |
| C��W3��W4��W1=W2 |
| D��W2��W1��W4��W3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����0.1 mol?L-1BA��Һ�У�c��A-��+c��H+��=c��BOH��+c��B+�� |
| B������0.1 mol?L-1 BOH��Һϡ����0.001 mol?L-1����Һ��pH=9 |
| C������һ��������������Һ��Ϻ�pH=7������Һ�У�c��A-����c��B+�� |
| D��������������Һ�������1��1��ϣ�����Һ�У�c��A-����c��B+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ѹǿ |
| B����������ƽ��Ħ������ |
| C�����������ܶ� |
| D�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Pb ���������� |
| B����Һ��pH���ϼ�С |
| C���ŵ�ʱ������Ӧʽ��PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| D����ҺpH�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����֪2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol����1mol����ȼ�շų�����Ϊ483.6 kJ |
| B����C��ʯī��s���TC�����ʯ��s����H=+11.9 kJ?mol-1��֪��ʯī�Ƚ��ʯ�ȶ� |
| C��ͬ��ͬѹ�£�H2��g��+Cl2��g���T2HCl��g���ڹ��պ͵�ȼ�����ġ�H��ͬ |
| D����ѧ�仯��һ���������������ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̼��Ƶķֽ� |
| B��̼������ͭ���������µķ�Ӧ |
| C��Ba��OH��2?8H2O�����NH4Cl������ |
| D��H2��O2�ڵ�ȼ�����µķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��MA��MB |
| B��MA��MB |
| C��MA=MB |
| D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����⻯��ˮ�⣺HS-+H2O=H2S��+OH- |
| B��̼�������Һ������������������Һ��ϣ�Ca2++HCO3-+OH-=CaCO3��+H2O |
| C������������Һ�е���ϡ���Fe2++NO3-+2H+=Fe3++NO��+H2O |
| D���Ȼ�����Һ�Ͱ�ˮ��Ӧ��Al3++3NH3?H2O=Al��OH��3��+3NH4+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com