
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA
B.常温常压下,18 g H2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.1 L 0.1 mol/L NaOH溶液含有阴阳离子总数为0.1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中Si+2OH-═SiO${\;}_{3}^{2-}$+H2 | |
| B. | 把Al中投入到少量氢氧化钠溶液Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42-”完全沉淀:Al3++2SO42-+2Ba2++2OH-═2BaSO4↓+Al(OH)3 | |
| D. | Na[Al(OH)4]溶液中加入过量的CO2:[Al(OH)4]-+CO2═HCO${\;}_{3}^{-}$+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
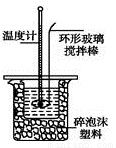
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNa OH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
OH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热无偏差时 简述理由 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(s)+2B(g) C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的压强 D.混合气体的总体积
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:计算题
把5.3%的Na2CO3溶液蒸发掉60g水后,溶液变为20mL,浓度变为15.9%,则浓缩后Na2CO3溶液的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外
B. 容量瓶中原有少量的蒸馏水
C. 容量瓶盛过Na2CO3溶液,使用前未洗涤
D. 定容时读数仰视
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
质量相等的下列物质中,含分子数最多的是
A.CH4 B.O2 C.NH3 D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com