
£Ø10·Ö£©ÓĆ18mol”¤L-1£¬ÅØĮņĖįÅäÖĘ100mL 3.0mol”¤L-1Ļ”ĮņĖįµÄŹµŃé²½ÖčČēĻĀ£ŗ
¢Ł¼ĘĖćĖłÓĆÅØĮņĖįµÄĢå»ż ¢ŚĮæČ”Ņ»¶ØĢå»żµÄÅØĮņĖį ¢ŪĻ”ŹĶ”¢ĄäČ“
¢Ü×ŖŅĘ”¢Ļ“µÓ ¢Ż¶ØČŻ”¢Ņ”ŌČ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĖłŠčÅØĮņĖįµÄĢå»żŹĒ_____mL£¬ĮæČ”ÅØĮņĖįĖłÓƵÄĮæĶ²µÄ¹ęøńŹĒ______£Ø“ÓĻĀĮŠ¹ęøńÖŠŃ”ÓĆ£ŗ
A£®10mL | B£®25mL | C£®50mL | D£®100mL £©”£ |
£Ø2£©ÅäÖĘÉĻŹöČÜŅŗĖłŠčŅĒĘ÷£¬³żĮæĶ²”¢ÉÕ±ŗĶ²£Į§°ōĶā£¬»¹±ŲŠėÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ______”¢__________”£
£Ø3£©µŚ¢Ż²½ŹµŃéµÄ²Ł×÷ŹĒ________________________”£
£Ø4£©ĻĀĮŠĒéæö¶ŌĖłÅäÖʵÄĻ”ĮņĖįÅضČÓŠŗĪÓ°Ļģ£æ£ØÓĆ”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±ĢīŠ“£©
¢Ł ĖłÓƵÄÅØĮņĖį³¤Ź±¼ä·ÅÖĆŌŚĆÜ·ā²»ŗƵÄČŻĘ÷ÖŠ_______________”£
¢Ś ¶ØČŻŹ±ø©ŹÓČÜŅŗµÄ°¼ŅŗĆę_______________________”£
 ×÷Ņµøص¼ĻµĮŠ“š°ø
×÷Ņµøص¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓ±±ĪäŅŲ֊ѧøßČżÉĻѧʌÖÜæ¼£Ø8.14£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©Ģś¼°Ęä»ÆŗĻĪļŌŚÉś»ī”¢Éś²śÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł»ĘĢśæó(FeS2)ŹĒÉś²śĮņĖįŗĶŅ±Į¶øÖĢśµÄÖŲŅŖŌĮĻ”£ĘäÖŠŅ»øö·“Ó¦ĪŖ3FeS2+8O2 6SO2+Fe3O4£¬Ńõ»Æ²śĪļĪŖ___________£¬ČōÓŠ3mol FeS2²Ī¼Ó·“Ó¦£¬×ŖŅĘ_____molµē×Ó”£
6SO2+Fe3O4£¬Ńõ»Æ²śĪļĪŖ___________£¬ČōÓŠ3mol FeS2²Ī¼Ó·“Ó¦£¬×ŖŅĘ_____molµē×Ó”£
¢ŚÓėĆ÷·ÆĻąĖĘ£¬ĮņĖįĢśŅ²æÉÓĆ×÷¾»Ė®¼Į£¬ĘäŌĄķĪŖ£ŗ___________(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
¢ŪFeC13ÓėĒāµāĖį·“Ó¦Ź±æÉÉś³É×ŲÉ«ĪļÖŹ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________________”£
£Ø2£©¼ŗÖŖ£ŗS2O32-¾ßÓŠ½ĻĒæµÄ»¹ŌŠŌ£¬ŹµŃéŹŅæÉÓĆI-²ā¶ØK2S2O8ѳʷµÄ“æ¶Č£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
S2O82-+2I-=2SO42-+I2 ¢Ł I2+2S2O32-=2I-+S4O62- ¢Ś
S2O82-”¢S4O62-”¢I2Ńõ»ÆŠŌĒæČõĖ³Šņ_______”£
£Ø3£©¼ŗÖŖČÜŅŗÖŠ£¬»¹ŌŠŌĪŖHSO3-£¾I-£¬Ńõ»ÆŠŌĪŖIO3-£¾I2>SO42-”£ŌŚŗ¬3 mol NaHSO3µÄČÜŅŗÖŠÖšµĪ¼ÓČėKIO3ČÜŅŗ£¬¼ÓČėµÄKIO3ŗĶĪö³öµÄI2µÄĪļÖŹµÄĮæµÄ¹ŲĻµĒśĻßČēĶ¼ĖłŹ¾”£

¢Łaµć“¦µÄ»¹Ō²śĪļŹĒ£ŗ________£ØĢīĄė×Ó·ūŗÅ£©£»
bµć”ścµć·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
¢Śµ±ČÜŅŗÖŠµÄI-ĪŖ0.5molŹ±”¢¼ÓČėµÄKIO3æÉÄÜŹĒ_________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗžÄĻ³¤É³ŹŠŠĀøßŅ»·Ö°ąæ¼ŹŌ»Æѧ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ģ¼»Æ¹č£ØSiC£©ĢÕ“É»łø“ŗĻ²ÄĮĻŹĒŅ»ÖÖŠĀŠĶČČ½į¹¹²ÄĮĻ”£ŌŚæÕĘųÖŠ£¬Ģ¼»Æ¹čÄÜÓėČŪČŚµÄĒāŃõ»ÆÄĘ·¢Éś·“Ó¦£ŗSiC+2NaOH+2O2=Na2SiO3+X+H2O£¬ĻĀĮŠÓŠ¹ŲXĪļÖŹµÄ»ÆѧŹ½ĶʶĻÖŠ£¬ÕżČ·µÄŹĒ( )
A£®SiO2 B£®CO C£®CO2 D£®Na2CO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź””¢ŅĖ“ŗŅ»ÖŠøßČż7ŌĀĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠø÷ÓŠ»ś»ÆŗĻĪļµÄĆüĆūÕżČ·µÄŹĒ(””””)
A£®CH2==CH”ŖCH==CH2””1,3¶ž¶”Ļ©
B£®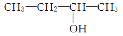 3¶”“¼
3¶”“¼
C£®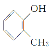 ¼×»ł±½·Ó
¼×»ł±½·Ó
D£®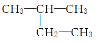 ””2¼×»ł¶”Ķé
””2¼×»ł¶”Ķé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź””¢ŅĖ“ŗŅ»ÖŠøßČż7ŌĀĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÉčNAĪŖ°¢·üŁ¤µĀĀŽ³£ŹżµÄŹżÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £Ø £©
A£®ĪļÖŹµÄĮæÅضČĪŖ0.5mol£ÆLµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl-øöŹżĪŖNA
B£®³£ĪĀ³£Ń¹ĻĀ£¬1.06gNa2C03ŗ¬ÓŠµÄNa+ŹżĪŖ0.02NA
C£®Ķس£×“æöĻĀ£¬NAøöC02·Ö×ÓÕ¼ÓŠµÄĢå»żĪŖ22£®4L
D£®7.8 g Na2SŗĶNa2O2µÄ»ģŗĻĪļÖŠŗ¬ÓŠµÄŅõĄė×ÓŹż“óÓŚ0.1 NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻµŚŅ»“ĪŌĀæ¼£ØæŖŃ§æ¼ŹŌ£©»Æѧ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
½«a g¶žŃõ»ÆĆĢ·ŪÄ©¼ÓČėb mol/LµÄÅØŃĪĖįc LÖŠ¼ÓČČĶźČ«Čܽā£¬·“Ó¦ÖŠ×ŖŅʵē×Ódøö£¬ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®æÉŅŌŹÕ¼Æµ½ĀČĘų L B£®·“Ó¦ŗóČÜŅŗÖŠµÄClØDŹżÄæĪŖ£ŗ
L B£®·“Ó¦ŗóČÜŅŗÖŠµÄClØDŹżÄæĪŖ£ŗ
C£®NAæɱķŹ¾ĪŖ£ŗ D£®·“Ó¦ŗóČÜŅŗÖŠµÄH£«ŹżÄæĪŖ£ŗ
D£®·“Ó¦ŗóČÜŅŗÖŠµÄH£«ŹżÄæĪŖ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻµŚŅ»“ĪŌĀæ¼£ØæŖŃ§æ¼ŹŌ£©»Æѧ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ķłŗ¬0.2molNaOHŗĶ0.1molCa(OH)2µÄČÜŅŗÖŠ³ÖŠųĪČ¶ØµŲĶØČėCO2ĘųĢ壬µ±ĶØČėĘųĢåµÄĢå»żĪŖ6.72LŹ±Į¢¼“Ķ£Ö¹£¬ŌņŌŚÕāŅ»¹ż³ĢÖŠ£¬ČÜŅŗÖŠĄė×ÓŹżÄæŗĶĶØČėCO2ĘųĢåµÄĢå»ż¹ŲĻµÕżČ·µÄĶ¼ĻóŹĒ£ØĘųĢåµÄČܽāŗöĀŌ²»¼Ę£©£Ø £©
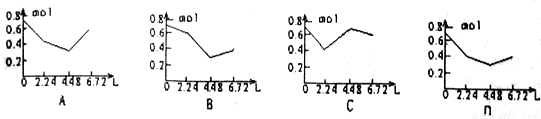
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČż7ŌĀŹīĘŚ½×¶ĪŠŌ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ļņ1Lŗ¬0.01molNaAlO2ŗĶ0.02molNaOHµÄČÜŅŗÖŠ»ŗĀżĶØČė¶žŃõ»ÆĢ¼£¬Ėęn(CO2)Ōö“ó£¬ĻČŗó·¢ÉśČżøö²»Ķ¬µÄ·“Ó¦£¬µ±0.01mol£¼n(CO2)”Ü0.015Ź±·¢ÉśµÄ·“Ó¦ŹĒ£ŗ
2NaAlO2+ CO2+2H2O=2Al(OH)3”ż+Na2CO3”£ĻĀĮŠ¶ŌÓ¦¹ŲĻµÕżČ·µÄŹĒ
Ń”Ļī | n(CO2)/mol | ČÜŅŗÖŠĄė×ÓµÄĪļÖŹµÄĮæÅØ¶Č |
A | 0 | c(Na+)£¾c(AlO2£)+c(OH£) |
B | 0.01 | c(Na+)£¾c(AlO2£)£¾ c(OH£)£¾c(CO32£) |
C | 0.015 | c(Na+)£¾ c(HCO3£)£¾c(CO32£)£¾ c(OH£) |
D | 0.03 | c(Na+)£¾ c(HCO3£)£¾ c(OH£)£¾c(H+) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğĮÉÄžŹ”“óĮ¬ŹŠø߶žĻĀĘŚÄ©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖµēĄėĘ½ŗā³£Źż£ŗH2CO3£¾HClO£¾HCO3©£¬Ńõ»ÆŠŌ£ŗHClO£¾Cl2£¾Br2£¾Fe3+£¾I2£®ĻĀĮŠÓŠ¹ŲĄė×Ó·“Ó¦»ņĄė×Ó·½³ĢŹ½µÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ£Ø £©
A£®Ļņ0.1molFeI2ČÜŅŗÖŠµĪ¼ÓÉŁĮæĀČĖ®£¬·“Ó¦ÖŠÓŠ0.3NAµē×Ó×ŖŅĘ
B£®ĻņäåĖ®ÖŠ¼ÓČė×ćĮæĀČ»ÆŃĒĢśÄÜŹ¹ČÜŅŗ±ä³ÉĪŽÉ«
C£®ĻņNaClOČÜŅŗÖŠĶØČėÉŁĮæCO2µÄĄė×Ó·½³ĢŹ½£ŗ2ClO©+CO2+H2OØT2HClO+CO32©
D£®ÄÜŹ¹pHŹŌÖ½ĻŌÉīŗģÉ«µÄČÜŅŗ£¬Fe3+”¢Cl©”¢Ba2+”¢Br©ÄÜ“óĮæ¹²“ę
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com