
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO ,则下列推断正确的是 ( )。
,则下列推断正确的是 ( )。
A.负极反应为H2+2OH--2e-===2H2O
B.该电池可在常温或高温时进行工作,对环境具有较强的适应性
C.该电池供应2 mol水蒸气,同时转移2 mol电子
D.放电时负极有CO2生成
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:填空题
(16分)Ⅰ.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)  C8H8(g)+H2(g) ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
C8H8(g)+H2(g) ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是_____ ___。
(2)该温度下,该反应的化学平衡常数是________ ________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
Ⅱ.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:

(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1 ④0.08 mol·L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.在标准状况下,11.2L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是:
A.CuCl2(CuO); B.NaOH(NaOH);
C.NaCl(HCl); D.CuSO4[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )。
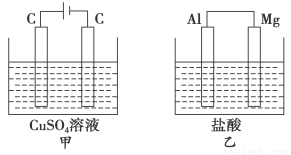
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )。
A.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+ (aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
标准状况下将VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=(17V+22400) /(22.4+22.4V) B.w=17c/(1000ρ)
C.w=17V/(17V+22400) D.c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氧化还原反应不一定有电子的得失或转移
B.有单质参加的化学反应一定是氧化还原反应
C.金属阳离子被还原一定得到相应的金属单质
D.碱性氧化物一定是金属氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
一混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后,测得A的浓度为0.5mol/L,当在恒温下将密闭容器的容积扩大1倍再达平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是
zC(g),达到平衡后,测得A的浓度为0.5mol/L,当在恒温下将密闭容器的容积扩大1倍再达平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是
A.x+y>z B.平衡向右移动
C.B的转化率升高 D.A的物质的量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com