
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 1 |
| 10 |
| m |
| M |
| 1 |
| 10 |
| n |
| V |
|
| 5.516g |
| 197g/mol |
| 0.028mol |
| 0.5L |
| 4.137g |
| 197g/mol |
| 1 |
| 10 |
| 0.005mol |
| 0.5L |


科目:高中化学 来源: 题型:
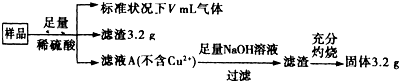
| A、滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B、V=896 |
| C、样品中CuO的质量为4.0g |
| D、样品中Fe元素的质量为2.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 2-甲基丁烷 2-甲基丁烷 |
| B、(CH3)2CHCH2CH2OH 1-戊醇 |
C、CH3- -CH3 1,4-二甲苯 -CH3 1,4-二甲苯 |
D、 2-甲基丙烯 2-甲基丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A、可能在同一平面上的原子最多有20个 |
| B、12个碳原子不可能都在同一平面上 |
| C、所有的原子都在同一平面上 |
| D、除苯环外的其余碳原子有可能都在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.400g | 7.900g | 7.100g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个体积为2L的密闭容器中,高温下发生下列反应:
在一个体积为2L的密闭容器中,高温下发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 化合物,但不是电解质 | |
| (5) | 不是电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
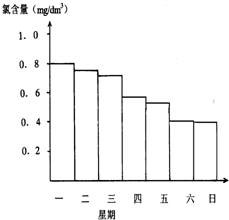 游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com