
| A. | NH4Cl溶液加水稀释,恢复至室温后,pH变大 | |
| B. | 稀释0.1 mol•L-1醋酸溶液,溶液中离子的浓度均变小 | |
| C. | 在 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 将A1C13溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体的成分相同 |
分析 A.酸性溶液加水稀释氢离子浓度减小;
B.酸性溶液加水稀释氢离子浓度减小,氢氧根离子浓度增大;
C.根据溶液中的电荷守恒分析;
D.盐溶液加热、蒸干、灼烧时,若水解生成挥发性酸,则最终得到氧化物,若水解生成难挥发性酸,则最终得到原电解质.
解答 解:A.NH4Cl溶液显酸性,加水稀释,水解程度增大,溶液的体积增大,由于水解平衡移动程度小于体积增大的程度,溶液中氢离子浓度会减小,则pH变大,故A正确;
B.醋酸溶液加水稀释,溶液的浓度减小,溶液中氢离子浓度减小,由于水的离子积不变,所以氢氧根离子浓度增大,故B错误;
C.电解质溶液中存在电荷守恒,即正电荷的浓度之和等于负电荷的浓度和,则在 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.盐溶液加热、蒸干、灼烧时,若水解生成挥发性酸,则最终得到氧化物,若水解生成难挥发性酸,则最终得到原电解质,所以将A1C13溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体分别为Al2O3、Al2(SO4)3;故D错误.
故选A.
点评 本题考查了盐的水解原理及影响因素,注意氯化氢和硫酸性质的不同导致加热并灼烧铝盐得到的固体类型不同,而加热蒸干并灼烧硝酸铝和氯化铝溶液时得到的固体物质相同,题目难度中等.


科目:高中化学 来源: 题型:填空题
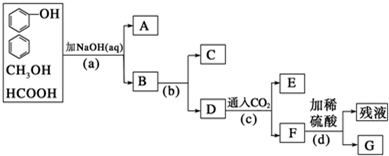
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 35% | C. | 30% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 25% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN变红的溶液中:Na+、Al3+、Cl-、S2- | |
| B. | 1.0 mol?L-1的Na2CO3的溶液中:NH4+、SO32-、Cl-、SO2 | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com