
| 0.252g |
| ag |
| 0.252 |
| a |
| 25.2 |
| a |
| 25.2 |
| a |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
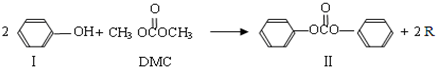
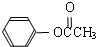 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
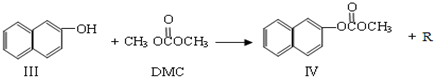
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是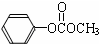 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体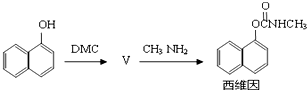
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol.L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制乙酸乙酯时,迅速将乙醇注入浓硫酸中 |
| B、在石油蒸馏装置中,将温度计水银球插入液面以下 |
| C、用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com