
| A、银镜反应实验后附着银的试管,可用稀H2SO4清洗 |
| B、在中学“硫酸铜晶体中结晶水含量测定”的实验中,称量操作至少需要三次 |
| C、不慎将浓H2SO4溅在皮肤上,立即用NaOH溶液冲洗 |
| D、在500 mL烧杯中,加入216g水和24gNaOH固体,配制10%NaOH溶液 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
 如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,断开S2接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池.关于该原电池的叙述正确的是( )
如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,断开S2接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池.关于该原电池的叙述正确的是( )| A、C(Ⅰ)的电极名称是负极 |
| B、C(Ⅱ)的电极名称是阳极 |
| C、C(Ⅰ)的电极反应式是2H++2e一=H2↑ |
| D、C(Ⅱ)的电极反应式是Cl2+2e-=2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgCl悬浊液中加入KI溶液:Ag++I-=AgI↓ |
| B、向Ba(OH)2溶液中滴加少量CuSO4溶液:Ba2++SO42-=BaSO4↓ |
| C、向Ca(HCO3)2溶液中滴加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向NaClO的碱性溶液中滴加少量CoCl2生成Co(OH)3沉淀:2Co2++ClO-+5H2O=2Co(OH)3↓+Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L 0.1 mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B、1mol羟基中电子数为10NA |
| C、等物质的量的O2和CO所含分子数均为NA |
| D、常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 8 |
| O | 2- 7 |
| O | 2- 4 |
2- 7 |
| O | 2- 8 |
| O | 2- 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL lmol?L-1Na2CO3溶液中溶质离子的总数为0.3NA | |||||||||||
B、若120g的墨粉(只含碳)能打a个字,则平均每个字约含有
| |||||||||||
C、25℃、l01 kPa时,0.1NA个H2分子完全燃烧生成液态水,放出akJ热量,表示氢气燃烧热的热化学方程式为H2(g)+
| |||||||||||
| D、常温下28g14CO中含有14NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
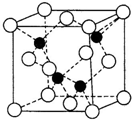 目前市售LED晶片,材质基本以GaAs(砷化镓)为主.已知镓、砷分别是铝、磷同主族下一周期的元素.砷化镓的晶胞结构如图所示.试回答:
目前市售LED晶片,材质基本以GaAs(砷化镓)为主.已知镓、砷分别是铝、磷同主族下一周期的元素.砷化镓的晶胞结构如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com