
 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.分析 (1)热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用;露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,据此分析解答;
(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l);
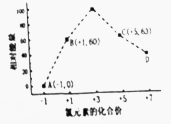
(3)①据图示分析相对能量最高时x为+3价;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,反应热△H=生成物总能量-反应物总能量,注意离子为溶液状态,进而书写热化学方程式;
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,所以符合环境保护理念的是BD;
故答案为:BD;
(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
(3)①据图示分析相对能量最高时x为+3价,故为C1O3-名称为氯酸根离子,
故答案为:氯酸根离子;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,根据离子能量可知,反应热△H=53kJ/mol+2×0kJ/mol-3×60kJ/mol=-117kJ/mol,故反应热化学方程式为:3 ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-═ClO3-+2Cl-.
点评 本题考查了热化学方程式的计算书写,盖斯定律的计算应用以及热化学方程式意义的计算等知识,题目较简单.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2C03 | Na2Si03 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
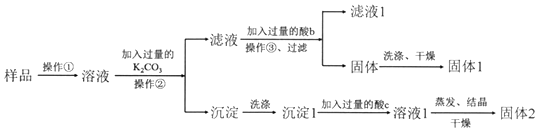
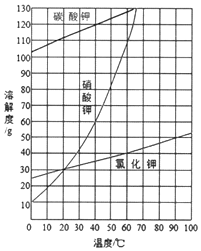
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当CaCO3的浓度不再变化时,表明达到平衡状态 | |
| B. | 重新达到新平衡时,CO2的压强为P | |
| C. | 扩大容器体积,重新达到平衡时n(CO2)增多 | |
| D. | 常温常压下CaCO3的分解反应不一定自发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+物质的量为0.2mol | B. | Na+物质的量浓度为0.2 mol•L-1 | ||
| C. | SO42-物质的量为0.1mol | D. | SO42-物质的量浓度为0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com