
分析 (1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)①设出达到平衡时甲醇的物质的量,然后根据达到平衡时甲醇的百分含量计算出达到平衡时各组分的物质的量及浓度,最后带人K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$计算出该温度下该反应的平衡常数;
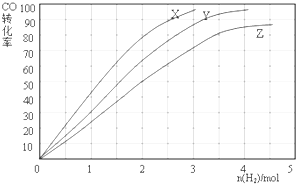
②合成甲醇是放热反应,升高温度平衡逆向移动,CO的转化率减小,则230℃时的实验结果所对应的曲线是X;
(3)①根据影响化学平衡的因素进行判断满足“平衡一定向正反应方向移动”的选项;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(4)根据lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ计算出1mol二甲醚完全燃烧放出的热量,然后根据热化学方程式的书写方法写出二甲醚燃烧热的热化学方程式.
解答 解:(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC,
故答案为:加热;
(2)①按反应a充分反应达到平衡后,设n(CH3OH)=xmol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)(g)
起始量(mol) 4 12 0 0
变化量(mol) x 3x x x
平衡量(mol) 4-x 12-3x x x
达到平衡时甲醇的含量为:$\frac{x}{4-x+12-3x+x+x}$×100%=30%,
解得:x=3,达到平衡时各组分的浓度为:c(CO2)=$\frac{4-3}{2}$mol/L=0.5mol/L,c(H2)=$\frac{12-9}{2}$mol/L=1.5mol/L,c(CH3OH)=c(H2O)=$\frac{3mol}{2L}$=1.5mol/L,
则该温度下反应的平衡常数为:K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$=$\frac{1.5×1.5}{0.5×1.{5}^{3}}$=$\frac{4}{3}$≈1.33,
故答案为:1.33;
②工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,当投入H2的物质的量相等时,从X到Z,CO的转化率在减小,说明反应逆向移动,而逆反应是吸热反应,需升高温度才能实现,230℃的实验结果所对应的曲线是X,
故答案为:X;当投入H2的物质的量相等时,从X到Z,CO的转化率在减小,说明反应逆向移动,而逆反应是吸热反应,需升高温度才能实现,故230°C为X;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故B正确;
C.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故C错误;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:BD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(4)1mol二甲醚的质量为46g,46g二甲醚完全燃烧生成稳定氧化物放出的热量为:31.63kJ×46g=1454.98 kJ,所以二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol,
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
点评 本题考查了化学平衡的调控作用、化学平衡的影响因素、原电池工作原理及电极反应的书写、化学平衡常数的计算、化学平衡状态的判断等知识,为高考常见题型,题目难度较大,考查的知识点较大,充分考查了学生对化学平衡、原电池工作原理等知识的掌握情况,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:推断题
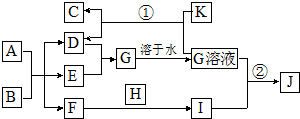 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL | |
| B. | 称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8gNaOH固体,放入100mL烧杯中,将烧杯中加满蒸馏水,同时不断搅拌至固体溶解 | |
| D. | 用100mL量筒量取40ml 5mol/L NaOH溶液,稀释后转移至100ml容量瓶中,洗涤并定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中加入双氧水 | |
| B. | 硫酸亚铁酸性溶液中滴加硝酸钾溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com