
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法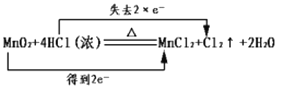
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
【答案】AC
【解析】
A. 化学反应中Mn的化合价由+4变为+2价,得2个电子,Cl的化合价由-1变为0价,失去2个电子,则电子转移的表示方法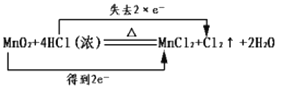 ,符合题意,A正确;
,符合题意,A正确;
B. 离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,反应中转移6个电子,则M2O7x-中M的化合价为+6,与题意不符,B错误;
C. 氧化性:氧化剂>氧化产物,则在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O,氧化性:XO4-> Z2;②2A2++B2=2A3++2B-氧化性:B2 > A3+;③2B-+Z2 =B2+2Z-氧化性:Z2 > B2;根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+,符合题意,C正确;
D. 已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为5:3,与题意不符,D错误;
答案为AC。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于验证某些物质的性质。在A试管中装入足量的固体NaHCO3。试回答下列问题:
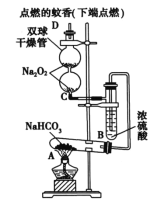
(1)在A试管内发生反应的化学方程式是_____________;
(2)B装置的作用是_____________________;
(3)在双球干燥管内发生反应的化学方程式为_________;
(4)实验时在C装置中观察到的现象是_______________;
(5)若将双球干燥管内的Na2O2换成Na2O,则实验时观察到的现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用胆矾(化学式![]() )配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
)配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
(1)配制该CuSO4溶液所需容量瓶的规格是___。
(2)同学们进行了以下操作,请将空白处填写完整。
①在托盘天平上称得相应质量的胆矾,将其放在___中,加入适量蒸馏水使其溶解。
②待固体全部溶解后,将溶液立即转移到容量瓶中。
③继续向容量瓶中加蒸馏水至液面离瓶颈刻度线下___cm时,改用___滴加蒸馏水至溶液的凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和___2~3次,每次洗涤的液体都小心转入相应容器中,并轻轻摇匀。
⑤盖好瓶塞,充分摇匀。
以上操作中有错误的一项是___(填序号,下同),这样操作的结果使所配溶液的浓度___(填“偏大”或“偏小”),将其改正后,配制CuSO4溶液的正确操作顺序是___
(3)取上述溶液10mL稀释至50mL,所得溶液中CuSO4的物质的量浓度为___。
(4)下列有关容量瓶的使用方法中,正确的是___(填字母)。
A. 使用容量瓶前检验是否漏水
B. 固体溶解后直接将溶液沿瓶颈倒入容量瓶中
C. 用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复颠倒,摇匀
D. 摇匀后容量瓶内液面下降,继续加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将在杂质除去,并写出相应的方程式(①②写离子方程式,③写化学方程式)。
物质 | 杂质 | 试剂/方法 | 离子/化学方程式 |
①FeCl2 | CuCl2 | ____ | _______ |
②Fe(OH)3 | Al(OH)3 | ____ | _______ |
③Al2O3 | Al(OH)3 | ____ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
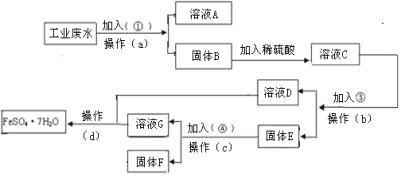
(1)若加入的试剂①为NaOH,加入试剂①的目的___。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、___。
(3)加入的试剂③为___(填化学式),发生的离子反应方程式为___。
(4)固体E的成分为Fe和Cu,写出E和加入试剂④所发生的离子反应方程式为__。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、冷却结晶、__、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
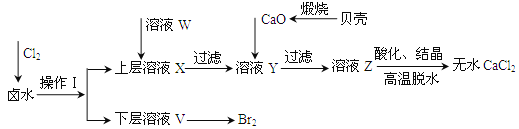
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
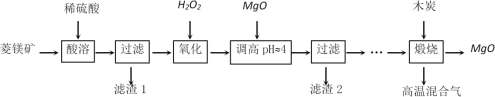
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
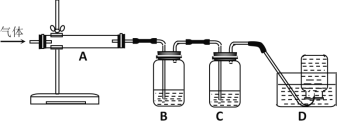
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com