
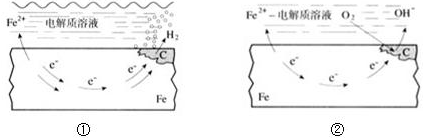
| A、碳表面发生氧化反应 |
| B、钢铁被腐蚀的最终产物为FeO |
| C、生活中钢铁制品的腐蚀以图①所示为主 |
| D、图②中,正极反应式为O2+4e-+2H2O═4OH- |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
| A、酸性溶液:Na+、Fe2+、AlO2-、SO42- |
| B、滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- |
| C、无色透明溶液:MnO4-、SO42-、K+、NO3- |
| D、强碱性的溶液:CO32-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
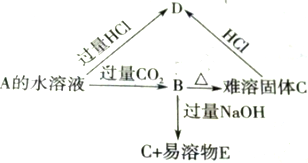 A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低
A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com