
 、
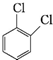
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.有机化合物中具有同一通式、组成上相差一个或多个某种原子团、在结构与性质上相似的化合物系列互为同系物.同素异形体是同种元素形成的不同单质.具有相同分子式而结构不同的化合物互为同分异构体.分子式相同结构相同为同种物质.
解答 解:①C60、C70、金刚石、石墨的碳元素的不同单质,互为同素异形体;
②C2H5OH、CH3OCH3 分子式相同结构不同,互为同分异构体;
③${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$质子数相同,中子数不同,互为同位素;
④HOCH2COOH、HOCH2CH2COOH、HOCH2CH2CH2COOH结构相似,在分子组成上相差一个或若干个CH2原子团的化合物,互为同系物;
⑤ 、
、 分子式相同,结构相同,是同种物质.
分子式相同,结构相同,是同种物质.
故选D.
点评 本题考查了几种常见的化学用语,难度不大,解答时注意从其概念的内涵与外延出发,缜密思考,正确解答.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
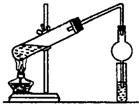 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
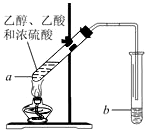 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
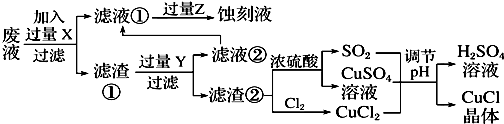
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com