
(9分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
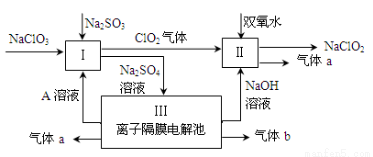
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(9分)
(1) Na2SO3 H2O (各1分)
(2) 2ClO2 + H2O2 + 2OH- = 2ClO2-+ O2↑+ 2H2O(2分)
(3) H2SO4 阳(各1分)
(4) 5NaClO2 + 4HCl = 5NaCl + 4ClO2↑ + 2H2O(2分)
(5) 相同(1分)
【解析】
试题分析:氯酸钠和亚硫酸钠与溶液A发生氧化还原反应生成硫酸钠和ClO2气体,则该反应中S元素的化合价升高,所以亚硫酸钠作还原剂;生成的硫酸钠进入电解池,则实质被电解的是水,所以水是还原剂也是氧化剂;过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和气体a,因为Cl元素的化合价降低,所以过氧化氢中O元素的化合价升高,则气体a为氧气;则气体b为氢气。
(1)根据以上分析,Ⅰ、Ⅲ中发生反应的还原剂分别是Na2SO3 、 H2O;
(2)Ⅱ中反应是过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和氧气,根据元素守恒,则产物中有水生成,所以反应的离子方程式是2ClO2 + H2O2 + 2OH- = 2ClO2-+ O2↑+ 2H2O;
(3)因为III是离子隔膜电解池,则阳极是氢氧根离子放电,导致阳极的氢离子浓度增大,硫酸根离子通过隔膜进入阳极区,所以产生氧气的一极同时产生硫酸,则溶液A的化学式为H2SO4,在阳极区产生;
(4)用亚氯酸钠和稀盐酸为原料制备ClO2,Cl元素的化合价有-1、+3、+4价,根据氧化还原反应规律,则亚氯酸钠中的Cl元素的化合价升高到+4价,同时降低到-1价,所以产物中有水、氯化钠生成,则化学方程式为5NaClO2 + 4HCl = 5NaCl + 4ClO2↑ + 2H2O;
(5)NaClO2变质可分解为NaClO3和NaCl,化学方程式为3 NaClO2=2NaClO3+NaCl,等质量的变质前后的NaClO2试样均配成溶液时,变质后的NaClO3和NaCl氧化亚铁离子时,实质是等量的NaClO2氧化亚铁离子,都是+3价Cl元素被还原为氯离子,转移电子的数目相同,所以消耗Fe2+的物质的量相同。
考点:考查制取亚氯酸钠的工业流程的分析,氧化还原反应的分析


科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
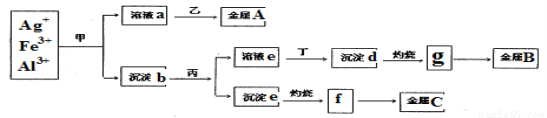
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。对该实验分析正确的是
A.甲是氢氧化钠,丁为稀硫酸
B.沉淀b为混合物,主要成分为沉淀d和沉淀e
C.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
D.金属A、B、C分别为Ag、 Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(12分)已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
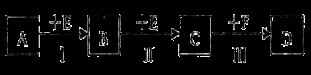
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为____________(填化学式)。
②将少景Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式__________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
化学与生产、生活和社会密切相关。下列说法不正确的是
A.漂白粉长期暴露在空气中会变质失效
B.雾霾天车灯照射的光亮通路属于丁达尔现象
C.硬铝属于合金材料,瓷器属于硅酸盐制品
D.不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
某硫酸厂废气中SO2的回收利用方案如右下图所示。下列说法不正确的是
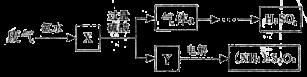
A.X可能含有2种盐 B.a是SO3
C.Y可能含有(NH4)2SO4 D.(NH4)2S2O8中S的化合价可能为+7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
某含Cr2O72-废水用硫酸亚铁铵[FeSO4?(NH4)2SO4?6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeO?FeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
A、消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B、处理废水中Cr2O72-的物质的量为(nx/2)mol
C、反应中发生转移的电子的物质的量为6nxmol
D、在FeO?FeyCrxO3中3x=y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
利用图中所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:选择题
50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
A.c(OH-)=10-2mol·L-1
B.加入少量NaOH固体,c(Na+)和c(CO32-)均增大
C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷(解析版) 题型:选择题
在208 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com