
下图为常温下用0.10mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
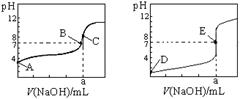
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH)>V(HA)
D.当0mL<V(NaOH)<20. 00mL时,溶液中一定是c(A-)>c(Na+)>c(H+) >c(OH-)
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
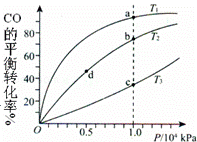
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
|
| A. | 温度:T1>T2>T3 |
|
| B. | 正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
|
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) |
|
| D. | 平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1 ②
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1 ③
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.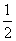 H2SO4(aq)+
H2SO4(aq)+ 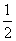 Ba(OH)2(aq)====
Ba(OH)2(aq)====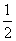 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)====CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)====CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)====CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)====2CO2(g) ΔH3<0
2H2(g)+O2(g)====2H2O(g) ΔH4<0
请回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量______途径Ⅱ放出的热量(填“大于”“等于”或“小于”)。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是________________________。
(3)由于制取水煤气的反应里,反应物具有的总能量_______(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为_________________。
(4)已知:Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是______________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为________________,电池工作时物质A可循环使用,A物质的化学式为________________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表回答问题:
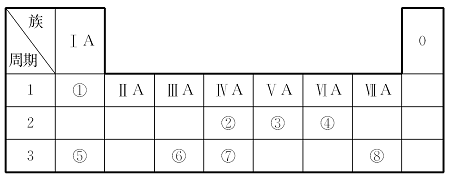
(1)元素⑦在周期表中的位置是___________________。
(2)元素①和⑤的原子序数相差 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式____
__________________________。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)____________
___________________________________________________________________,
其中能与元素⑥形成的单质反应的化学方程式为_________________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ·mol-1表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在融熔时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com