
科目:高中化学 来源:不详 题型:填空题
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |

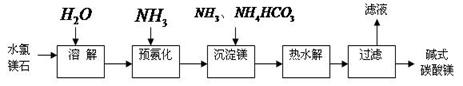
 的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为 kg。
质量为 kg。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

|
 成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。 ▲ (写化学式)。
▲ (写化学式)。 分子筛。
分子筛。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素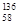 Ce、 Ce、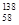 Ce、 Ce、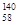 Ce、 Ce、 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
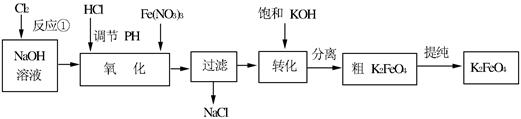
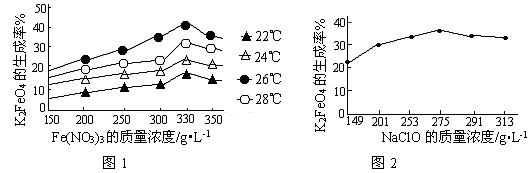
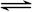 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
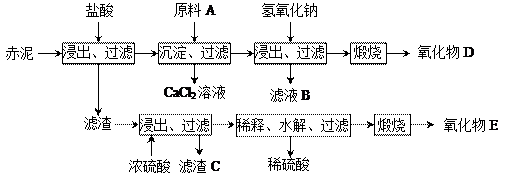 |
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
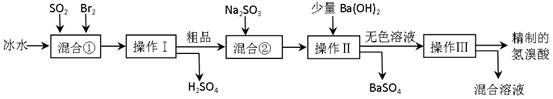
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘(海带) | B.溴(海水晒盐后的余液) |
| C.乙烯(乙醇) | D.顺丁橡胶(石油裂解气) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com