

���� ��1��ʵ���Ʊ������к����������Ȼ����ˮ������ͨ��Eװ��ʱ��Ҫ��ȥ���ʣ�����ͨ������ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ж������ŵ������У�Ҫ����β�����գ�
��2��װ�����п����������е������ܹ���������������ԭ���ݴ˷�������Ȼ�����G�е��������Ʒ�Ӧ������������������
��3��A�м���Ũ������������̷�Ӧ�����������Ȼ��̺�ˮ��E������������Ӧ�����Ȼ�����
��� �⣻��1��Ũ�����ӷ����Ʊ��������к����Ȼ��⣬�����ڱ����Ȼ�����Һ���ܽ��С���Ȼ���������ˮ�����ñ����Ȼ�����Һ��ȥ�����е��Ȼ��⣻�����ж���Ӧ����β�������������ܹ����������ƣ�������������ҺҺ���գ�
�ʴ�Ϊ������ʳ��ˮ������������Һ��
��2��װ�����п�����Ϊ��ֹ�����е�������������Ӧ���Ʊ��������������ž�װ���еĿ���������Ӧ�ȵ�ȼA���ƾ��ƣ��Ȼ�����G�е��������Ʒ�Ӧ��������������������ѧʽΪ��Fe��OH��3��
�ʴ�Ϊ��A�����߿�������ֹ��������������Fe��OH��3��
��3��A�м���Ũ������������̷�Ӧ�����������Ȼ��̺�ˮ����ѧ����ʽ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��E������������Ӧ�����Ȼ�������ѧ����ʽ��2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3��
�ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O 2Fe+3Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2FeCl3 ��
���� ���⿼�����������Ʊ������ʵļ��飬��ȷ�����Ʊ�ԭ���ͻ�ѧ�����ǽ���ؼ���ע��װ�������Լ��鷽������Ŀ�ѶȲ���


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�1 mol Fe������ϡHNO3��Ӧ��ת�Ƶ��ӵ���ĿΪ2 NA | |
| B�� | 18 g D2O�к��е�������ĿΪ10 NA | |
| C�� | ��״���£�22.4 L���ȼ���ķ�����ԼΪNA | |
| D�� | 28 g��C2H4��C3H6��ɵĻ�����к�����ԭ�ӵ���ĿΪ4 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
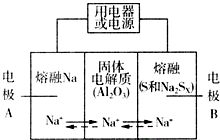 �����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$ 2Na+XS ��3��X��5��
�����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$ 2Na+XS ��3��X��5��| ���� | Na | S | Al2O3 |
| �۵�/�� | 97.8 | 115 | 2050 |
| �е�/�� | 892 | 444.6 | 2980 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3 | B�� | 4 | C�� | 5 | D�� | 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ����һ�ֹ��ʻ��������� | |
| B�� | 1mol����������Ϊ1g | |
| C�� | ��ͬ��ͬѹ�£���ͬ������κ�����������������ͬ | |
| D�� | ��״���£�1mol�κ����ʵ������ԼΪ22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
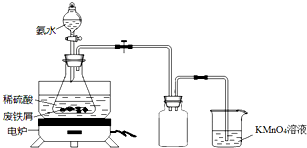 ijʵ��С���÷���м��������S��Ԫ�أ�Ϊԭ���Ʊ����������������ؾ���[K3Fe��C2O4��3•3H2O]���ⶨ����ɣ�
ijʵ��С���÷���м��������S��Ԫ�أ�Ϊԭ���Ʊ����������������ؾ���[K3Fe��C2O4��3•3H2O]���ⶨ����ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 H2PO4-+H+��
H2PO4-+H+��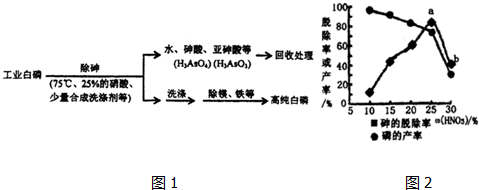
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
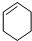 ��1-��Ȳ ��
��1-��Ȳ �� ��
��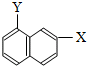 ��
�� ��
��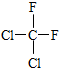
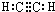 ��C�Ľṹ��ʽ��CH2=CH-CH=CH2��E�ļ���ʽ��
��C�Ľṹ��ʽ��CH2=CH-CH=CH2��E�ļ���ʽ��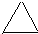 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +��8-$\frac{2}{3}$m�� | B�� | +��8-2m�� | C�� | +��8-$\frac{3}{2}$m�� | D�� | +��8-3m�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com