
 Ⅰ.纯碱、烧碱等是重要的化工原料.
Ⅰ.纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中, |
原白色固体中有OH-存在 |
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量氯化钡(或氯化钙)溶液 | 产生白色沉淀 | 原白色固体中有CO32-存在 |
| ②过滤,取2mL滤纸于试管中,滴加酚酞 | 溶液变红 | 溶液中含有氢氧化钠 |
| 实验操作 | 实验现象 | 结论 |
| 产生白色沉淀 | 原白色固体中有CO32-存在 | |
| 滴加酚酞 | 溶液变红 |


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
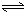 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O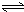 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O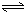 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O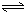 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全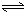 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O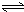 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O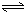 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O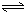 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全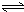 Cr2O72-+H2O
Cr2O72-+H2O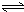 Cr2O72-+H2O
Cr2O72-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
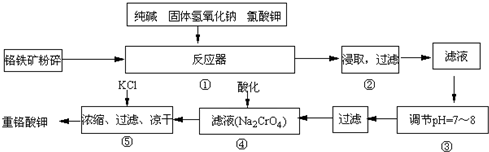
 12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下: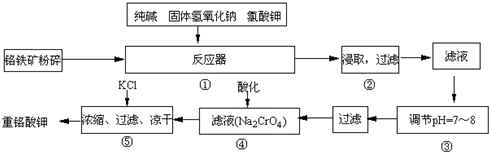
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:2009年江苏省南通市通州区平潮高级中学高考化学模拟试卷(十)(解析版) 题型:填空题
 12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
查看答案和解析>>
科目:高中化学 来源:2009年江苏省淮安市淮阴中学高考化学模拟试卷(三)(解析版) 题型:填空题
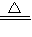 12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下: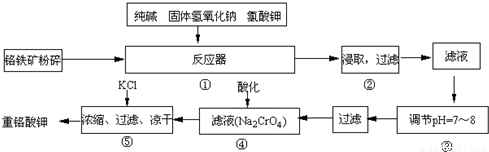
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com