
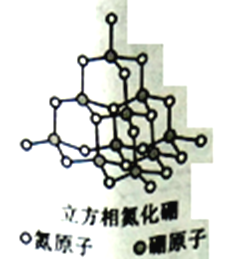
����Ŀ������������CBN( Cubic Boron Nitrde)��Ӳ�Ƚ����ڽ��ʯ��ԶԶ�����������ϣ����������ʯͳ��Ϊ��Ӳ���ϣ������������ĥ�ԡ��侧��ṹ����ͼ��ʾ��
��1����̬��ԭ�ӵļ۵��Ӳ��Ų�ʽ��_____________���ڵ�����ԭ�����ڵ������У���һ������С�ڵ�ԭ�ӵ���_____��Ԫ�ص�ԭ�ӡ�
��2����ԭ�Ӻ���ԭ���γɵĻ�ѧ��������_____________________��
��3����ԭ�ӵ��ӻ�������_______������ԭ�ӽ�������4����ԭ�ӵĿռ乹����________��������_______ ��
��4��������ͼ��ʾ���þ�������______������
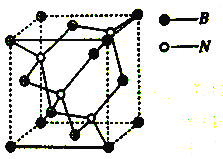
��5�������������ӵ���С��������Ԫ����ÿ����ԭ�ӱ�_____����Ԫ�����ã���Ԫ�������_____��ԭ����ͬһƽ���ϡ��������߳�Ϊapm��������������ܶ�����g/cm3����NA�ı���ʽ��____(��a������ʾ)��
���𰸡� 2s22p3 5 ���ۼ�����λ�� sp3 �������� 109��28���109.5�� ԭ�� 12 4 ![]() ��1030
��1030
����������1����̬��ԭ�ӵļ۵��Ӳ��Ų�ʽ��2s22p3���ڵ�����ԭ�����ڵ������У���һ������С�ڵ�ԭ�ӵ���
��2����ԭ����sp2�ӻ�������γ������Ҽ�����ԭ����sp3�ӻ�������γ�һ���Ҽ������м������Ե�ԭ�Ӻ���ԭ���γɵĻ�ѧ�������й��ۼ�����λ����
��3����ԭ�ӵ��ӻ�������sp3�������ڽ��ʯ�Ľṹ���� ��������ԭ�ӽ�������4����ԭ�ӵĿռ乹��������������������109��28�䡣
��������ԭ�ӽ�������4����ԭ�ӵĿռ乹��������������������109��28�䡣
��4����Ϊ�����������Ӳ�Ƚ����ڽ��ʯ��ԶԶ�����������ϣ���������ʯͳ��Ϊ��Ӳ�������þ�������ԭ�Ӿ�����
��5����ͼ֪�����������ӵ���С��������Ԫ����ÿ����ԭ�ӱ�12����Ԫ�����ã���Ԫ�������4
��ԭ����ͬһƽ���ϡ��������߳�Ϊapm��������������ܶ�����g/cm3�����ݾ���Ľṹһ����������ԭ����8![]() 1/8+6
1/8+6![]() 1/2=4����ԭ�����������ڹ�4�������Ի�ѧʽΪB4N4
1/2=4����ԭ�����������ڹ�4�������Ի�ѧʽΪB4N4
��g/cm3= ![]() 1030 NA=
1030 NA=![]() 1030����𰸣�12 4
1030����𰸣�12 4 ![]() 1030
1030



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
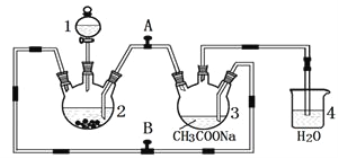
����Ŀ�������Ǹ�ˮ���� {[(CH3COO)2Cr]2��2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���dz��õ��������ռ���ʵ��������п�������Ȼ�����Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ����:
Zn��s��+ 2HCl��aq��=ZnCl2��aq��+ H2��g����
2CrCl3��aq��+Zn��s��= 2CrCl2��aq��+ ZnCl2��aq��
2Cr2+��aq��+ 4CH3COO����aq��+ 2H2O��l��=[(CH3COO)2Cr]2��2H2O��s��
��ش���������:
��1������1��������______________________________________��
��2��������2�м���������Ȼ�����Һ��˳�������____________(�����)��Ŀ����_________________________��
A.��������Ȼ�����Һͬʱ����
B.�ȼ����Ȼ�����Һ��һ��ʱ����ټ�����
C.�ȼ����ᣬһ��ʱ����ټ����Ȼ�����Һ
��3��Ϊʹ���ɵ�CrCl2��Һ���������Һ˳����ϣ�Ӧ�رշ���_____(����A������B"����ͬ)������____��
��4����ʵ����п��Ҫ��������ԭ������ò�����H2��CrCl2��Һѹ��װ��3���������Һ��Ӧ�⣬��һ��������_____________________________________________��
��5����֪������Ӧ��������ʵ��ʱȡ�õ�CrCl3��Һ�к�����9.51g��ȡ�õĴ�������ҺΪ1.5L0.1mol/L��ʵ���ø��﴿����[(CH3COO)2Cr]2��2H2O 9.4g�����ʵ�����ò�Ʒ�IJ���Ϊ____________(�������ܽ�Ĵ����Ǹ�ˮ����)��
��6���������ӻ���Ⱦˮ��������Ҫ��ȥ����ʵ���ж����Cr2+���������Һ��ͨ��������_______���ټ����Һ������pH����Ϊ_______�����Ǹ������ӳ�����ȫ(��������Ũ��ӦС��10-5mol/L)������֪Cr(OH)3���ܶȻ�Ϊ6.3��10-31��![]() ��4��lg2��0.3��
��4��lg2��0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��Σ����Ϊ���صĴ�����Ⱦ��֮һ��SO2�ĺ����Ǻ���������Ⱦ��һ����Ҫָ�ꡣ��ҵ�ϳ����ô���ԭ�������շ�����SO2������ԭSO2������������SO2��Ⱦ�����ҿɵõ��м�ֵ�ĵ���S��
��1���ڸ�����ִ��������£�CH4��ʹSO2ת��ΪS��ͬʱ����CO2��H2O����֪CH4��S��ȼ���ȷֱ�Ϊ890.3kJ/mol��297.2kJ/mol��CH4��SO2��Ӧ���Ȼ�ѧ����ʽΪ______________________��
��2����H2��ԭSO2����S�ķ�Ӧ��������ɣ���ͼ1��ʾ���ù�����������ʵ����ʵ���Ũ����ʱ����仯��ϵ��ͼ2��ʾ��
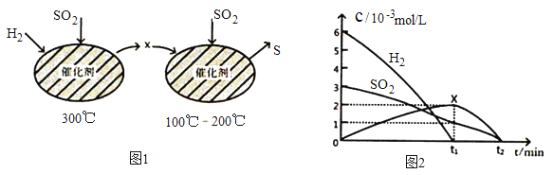
��������֪XΪ____________(д��ѧʽ)��0~t1ʱ��ε��¶�Ϊ_________��0~t1ʱ�����SO2��ʾ�Ļ�ѧ��Ӧ����Ϊ________________________________��
���ܷ�Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3����ҵ�Ͽ���Na2SO3��Һ����SO2���÷�Ӧ�����ӷ���ʽΪ__________________________���Ƚ�Na2SO3��Һ�и�����Ũ�ȵĴ�С��ϵΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����0.2molL��1Na2CO3��Һ250mLʾ��ͼ��

�ش��������⣺
��1�����гƵ�Na2CO3 g��
��2���������������������е����÷ֱ��� �� ��
��3�������������������������ҺŨ���к�Ӱ�죿������ƫ��������ƫ����������Ӱ������
A��ijͬѧ�ڵ������۲�Һ��ʱ���� ��
B��û�н��в������������� ��
C���ڵ���������������Һ����������ƿ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�㷺�ش���������������֮�С����й��������漰������ԭ��Ӧ���ǣ� ��
A.ȼ�ű���B.ʳ�︯��
C.����ұ��D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʵ�����Ƶõ���ϩ��C2H5OH![]() CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����
CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����

A. װ������װ�����ж�ʢ��ˮ����������ͬ
B. װ������װ�����ж�ʢ��NaOH��Һ�������յ�������ͬ
C. ������÷�Һ�ķ������з��룬1��2����������Ӧ�ӷ�Һ©�����Ͽڵ���
D. �Ʊ���ϩ������1��2����������ķ�Ӧ���ͷֱ�����ȥ��Ӧ�ͼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ʵ������ȡ������˵������ȷ���ǣ� ��
A.����Ũ������鰱��
B.����Ũ������ﰱ��
C.���������ſ������ռ�����
D.�ɽ�Ũ��ˮ����ʢ����ʯ�ҵ���ƿ��ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ס��������л����ڳ��³�ѹ�µĻ������롣��֪���ǵ������������£�
���� | �ܶ�/(g/cm3) | �е�/�� | ˮ���� | �ܽ��� |
�� | 0.7893 | 68.5 | �� | ������ |
�� | 1.220 | 100.7 | �� | ���ڼ� |
��Ӧ���õķ��뷽����( )
A. ��Һ B. ���� C. ���� D. ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������������ͼ��ʾʵ��װ�ã��ش��������⡣

��1��д���������������ƣ�
��_____________�� ��_____________��
��2��������װ�â����ƾ���ˮ�Ļ�����ȱ�� ��������_____________��������������������е�ʵ�����������Ϊ________���ڵĽ�ˮ����______(�f����g��)��ʵ���У���������������ʯ��������Ϊ________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com